(16分)A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去):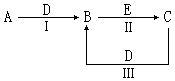
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C的电子式为_______________.
②写出反应Ⅱ的化学方程式______________________.
(2)若A是淡黄色化合物,常温下D是无色气体,C中含有的阴、阳离子均为10电子粒子.
①C中所含化学键的类型是____________.
②写出反应Ⅲ的离子方程式______________________.
(3)将(2)中一定量的气体D通入2 L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为_____________,a点溶液中各离子浓度由大到小的关系是_______________.
②标准状况下,通入气体D的体积为_____L,C溶液的物质的量浓度为_____mol·L-1.
(1) ( 6分) 书写下列离子方程式:
实验室制取CO2 ___ ___________________________________________________________________
___________________________________________________________________
硫酸铜溶液与氢氧化钡溶液_____________________________________
CO2 通入足量氢氧化钠_______________________________________
通入足量氢氧化钠_______________________________________
(2)写出下列物质的电离方程式:
NaHSO4_______,
H2CO3________。
(10分)以下12种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2⑩Fe(OH)3 ⑪NaOH ⑫NH3·H2O
请按下列分类标准回答问题。
(1)属于电解质的是__________________________。
(2)能电离出H+的是________。
(3)属于碱的是________________,其中属于难溶性碱的是________。
(4)属于难溶性盐的是_______。
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2 ↑ +2H2O。试回答下列问题:
CuSO4+SO2 ↑ +2H2O。试回答下列问题:
(1)反应①中元素被还原,反应②中元素被还原。(填元素符号)
(2)当反应①生成2g H2时,消耗H2SO4的质量是。
(3)反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有g H2SO4作为氧化剂被还原。
g ,其中有g H2SO4作为氧化剂被还原。
有A、B、 C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
 ”表示有气体生成,“—”表示没有明显现象):
”表示有气体生成,“—”表示没有明显现象):
| A |
B |
C |
D |
E |
|
| A |
 |
↓ |
— |
↓ |
— |
| B |
↓ |
↓ |
— |
||
| C |
— |
↓ |
↑ |
— |
|
| D |
↓ |
↓ |
↑ |
↓ |
|
| E |
— |
— |
— |
↓ |
(1)请写出A、B、C、D 、E各溶液中溶质的化学式:
、E各溶液中溶质的化学式: ABCDE
ABCDE
(2)请写出A+B,C+D,D+E反应的离子方程式
①A+B:
②C+D:
③A+D:
根据要求填写:
(1)金属钠在空气中燃烧,火焰呈色,化学方程式:;
(2)将过氧化钠固体放入试管中加入少量水,再加入几滴酚酞试液,溶液变红色但很快褪色,原因是:,过氧化钠固体与水反应的化学方程式: ;
;
(3)苏打和小苏打分别和同浓度的盐酸反应,反应较快且剧烈的是(填化学式),小苏打与盐酸反应的离子方程式为: ;
;
(4)金属钠和金属钾分别和水反应试验中,其中反应较剧烈的反应的化学方程式:;