锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-= C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-= LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是
| A.锂电池充电时电池反应为C6Li+Li1-xMO2 = LiMO2+C6Li1-x |
| B.在电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小 |
| C.锂电池放电时电池内部Li+向负极移动 |
| D.锂电池充电时阴极反应为C6Li1-x+xLi++xe-= C6Li |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)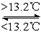 Sn(s,白) ΔH3 = +2.1 kJ·mol-1下列说法正确的是
Sn(s,白) ΔH3 = +2.1 kJ·mol-1下列说法正确的是
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e- →Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-→4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
钢铁在锈蚀过程中,下列五种变化 :①铁由+2价转化为+3价;②氧气被还原;③产生氢气;④氢氧化铁失水形成Fe2O3·H2O;⑤杂质碳被氧化。可能发生的是
| A.①② | B.③④ | C.①②③④ | D.①②③④⑤ |
在下图各烧杯中盛有海水,铁在其中腐蚀速率由快到慢的顺序是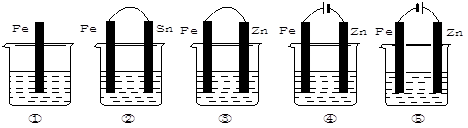
| A.①>②>③>④>⑤ | B.⑤>④>③>②>① |
| C.④>②>①>③>⑤ | D.②>③>⑤>①>④ |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |