下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是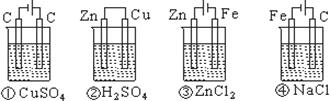
| A.工作一段时间后溶质的物质的量浓度①=②=③=④ |
| B.工作一段时间后溶液的pH:④>③=①>② |
| C.产生气体的总体积:④>②>①>③ |
| D.电极上析出的固体的质量:①>②>③>④ |
下列各溶液中,物质的量浓度关系正确的是()
| A.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| B.常温下,10 mL 0.01 mol·L-1HCl溶液与10 mL 0.01 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C.0.1 mol·L-1的KAl(SO4)2溶液中:c(SO42-)>c(Al3+)>c(OH-)>c(H+) |
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液, 若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) 若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下图是一种航天器能量储存系统原理示意图。下列说法正确的是()
| A.该系统中只存在3种形式的能量转化 |
| B.装置X能实现燃料电池的燃料和氧化剂再生 |
| C.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
已知可逆反应X(g)+Y(g)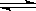 Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是()
Z(g)(未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是()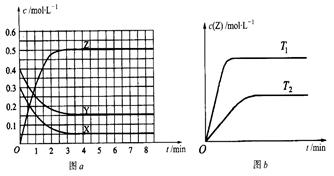
| A.发生反应时,各物质的反应速率大小关系为:v(X)=" v(Y)=" 2v(Z) |
| B.图a中反应达到平衡时,Y的转化率为37.5% |
| C.T0℃时,该反应的平衡常数为33.3 |
| D.该反应正反应的反应热△H<0 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列 说法错误的是()
说法错误的是()
| J |
||
| R |
A. J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的M的氧化物方法来制备M
C. R、T两元素的气态氢化物中,T的气态氢化物更稳定
D. J、M、R、T元素最高价氧化物对应的水化 物中酸性最强的是HTO4
物中酸性最强的是HTO4
下列离子反应方程式正确的是()
| A.用澄清石灰水来吸收氯气:Cl2+OH—=Cl—+ClO—+H+ |
B.向稀硝酸中加入少量铁粉:3Fe+8H+ +2NO3—=3Fe2++2NO↑+4H2O +2NO3—=3Fe2++2NO↑+4H2O |
C.将金属钠加入冷水中:2Na+2H 2O=2Na++2OH—+H2↑ 2O=2Na++2OH—+H2↑ |
| D.碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3—+2OH—=CaCO3↓+CO32-+2H2O |