某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )
| A.Al3+、NO3―、K+、SO42ˉ | B.Ca2+、H+、CO32ˉ、AlO2― |
| C.OHˉ、SO42ˉ、NH4+、Al3+ | D.Fe3+、Mg2+、NO3ˉ、Clˉ |
Li—SO2电池具有输出功率高且低温性能好的特点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动。电池总反应式为:2Li+2SO2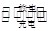 Li2S2O4。下列有关该电池的说法正确的是()
Li2S2O4。下列有关该电池的说法正确的是()
| A.放电Li+向正极移动 |
| B.该电池溶剂可用水替代 |
| C.该电池放电时,1mol SO2参与反应,转移2mol e- |
| D.充电阳极反应式为2Li++2SO2+2e-=Li2S2O4 |
已知25℃时有关弱酸的电离平衡常数: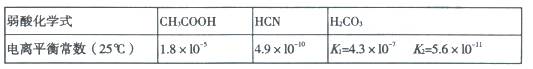
下列有关说法正确的是()
| A.NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) |
| B.1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性 |
| C.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
| D.1mol/L醋酸溶液加水稀释,所有离子浓度均减小 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是()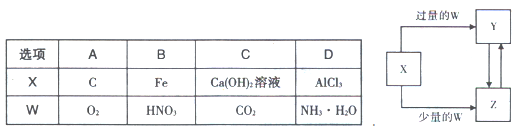
下述实验设计能够达到目的的是()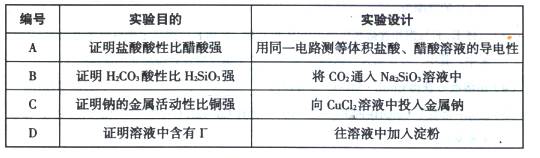
下列关于氯水的叙述正确的是()
| A.氯水中只存在一种电离平衡 |
| B.向氯水中通入SO2,其漂白性增强 |
| C.向饱和氯水中通入氯气,c(H+)/c(ClO一)减小 |
| D.向氯水中加入NaOH至中性,溶液中c(Na+)=c(Cl一)+c(CIO一) |