现有碳酸氢钠和碳酸钠固体混合物,为了测定混合物中碳酸钠的百分含量,利用如下装置: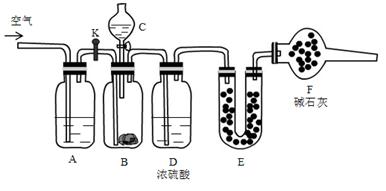
实验步骤:
①检查装置气密性
②将药品装好,其中B中装入 9.5g样品,E装好药品后,称量总质量56.0g
③关闭活塞K,打开分液漏斗活塞,放下液体,充分反应
④待B中完全反应后,打开活塞K,通入一会儿空气
⑤称量E装置质量为60.4 g
回答下列问题:
(1)C中装的药品是 ,E中药品是 ,F中药品的作用 。
(2)A中发生反应的离子方程式为 。
(3)样品中碳酸钠的质量百分含量为 。
(4)若实验中后期不通入空气,则所测得样品中碳酸钠的百分含量 (填“偏小”“偏大”“不影响”)
(8分)实验室里常用氯化铵和足量熟石灰混合加热制取氨气。
(1)若需要500 ml (标准状况)氨气,至少需称取氯化铵的质量是多少?(用托盘天平称量)
(2)若将5000 ml (标准状况)氨气溶于水配成100 ml 溶液,则氨水中NH3的物质的量浓度是多少?( 不考虑NH3与水的反应)
羧酸A和醇B(A、B中均只有一个官能团)形成的酯C,已知:①2.2g C燃烧可生成4.4gCO2和1.8g H2O;②1.76g C与50mL 0.5 mol· L—1的NaOH溶液共热后,为了中和剩余的碱液,耗去0.2 mol· L—1的盐酸25mL;③取C水解后所得的醇B 0.64g,跟足量的钠反应时,标况下收集到224mL H2。求:
(1)C的相对分子质量、分子式、结构简式;
(2)写出C与 NaOH共热反应的化学方程式。
已知4.6克无水乙醇在氧气中完全燃烧,只生成8.8克CO2 和5.4克H2O,则无水乙醇中含有哪几种元素?写出其化学式?完成乙醇燃烧的化学方程式。
在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:
NO2+CO  CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:
(1)此段时间内,用CO2表示的平均反应速率为 。
(2)2 min时,CO 的转化率为。
(3)假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量(填“大于”、“小于”或“等于”)开始时容器内气体的总物质的量。
工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2 2Fe2O3+8SO2①
2Fe2O3+8SO2①
FeS2+2HCl→ FeCl2+H2S↑+S↓②
2H2S+SO2→ 3S+2H2O③
2NaOH+SO2→Na2SO3+H2O④
Na2SO3+S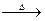 Na2S2O3⑤
Na2S2O3⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?