已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若平衡时,保持容器容积不变,在密闭容器中再充入2mol A,则反应达到平衡时, A的转化率_______ (填“无影响”、“增大”、“减小”),B的转化率_______ (填“无影响”、 “增大”、“减小”),
白云石的主要成份是
,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现
、
的分离。碳化反应是放热反应,化学方程式如下:
完成下列填空
23.
的碱性比
的碱性(选填"强"或"弱")
的溶解度比
的溶解度(选填"大"或"小")
24.碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是、。温度偏低也不利于碳化反应,原因是。
25.已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10
到13
之内钙离子的反 应速率为。15
之后钙离子浓度增大,原因是(用化学方程式表示)。
26.
原子核外电子排布式为;
原子最外层电子的能量
原子最外层电子的能量(选填"低于"、"高于"或"等于")。
氟在自然界中常以
的形式存在。
(1)下列关于
的表述正确的是。
a.
与
间仅存在静电吸引作用
b.
的离子半径小于
,则
的熔点高于
c.阴阳离子比为2:1的物质,均与
晶体构型相同
d.
中的化学键为离子键,因此
在熔融状态下能导电
(2)
难溶于水,但可溶于含
的溶液中,原因是(用离子方程式表示)。
已知
在溶液中可稳定存在。
(3)
通入稀NaOH溶液中可生成
,
分子构型为,其中氧原子的杂化方式为。
(4)
与其他卤素单质反应可以形成卤素互化物,例如
、
等。已知反应
,
键的键能为
,
键的键能为
,则
中
键的平均键能为
。
的熔、沸点比
的(填"高"或"低")。
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(
)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(
)。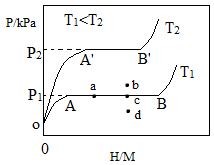
在
段,氢溶解于
中形成固溶体
,随着氢气压强的增大,
逐惭增大;在
段,
与氢气发生氢化反应生成氢化物
,氢化反应方程式为:
;在
点,氢化反应结束,进一步增大氢气压强,
几乎不变。反应(Ⅰ)中
=(用含x和y的代数式表示)。温度为T1时,2
某合金4
内吸收氢气240
,吸氢速率
=mL•
min。反应的焓变△HⅠ0(填">""<"或"=")。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)η(T2)(填">""<"或"=")。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的点(填"b""c"或"d"),该贮氢合金可通过或的方式释放氢气。
(3)贮氢合金
可催化由
、
合成
的反应,温度为T时,该反应的热化学方程式为。已知温度为T时:
利用
和钴氧化物可制备锂离子电池正极材料。
可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为
和
溶液。
极区电解液为溶液(填化学式),阳极电极反应式为,电解过程中
向电极迁移(填"A"或"B")。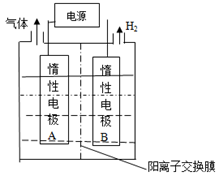
(2)利用钴渣[含
、
等]制备钴氧化物的工艺流程如下: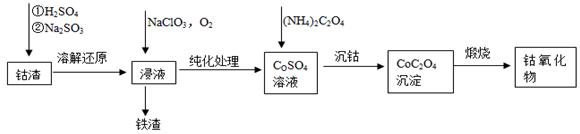
溶解还原反应的离子方程式为,铁渣中铁元素的化合价为,在空气中煅烧
生成钴氧化物和
,测得充分煅烧后固体质量为
,
的体积为
(标准状况),则钴氧化物的化学式为。
(12分)【选做题】本题包括A、B两小题,请选定一中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]下列反应曾用于检测司机是否酒后驾驶:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为______________;1molCH3COOH分子中含有δ键的数目为______。
(3)与H2O互为等电子体的一种阳离子为________(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为___________。