下面有关晶体的叙述中,错误的是( )
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
短周期元素W、X、Y、Z的原子序数依次增大,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的最外层电子数等于其最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.元素Y的气态氢化物比W的稳定 |
| B.元素Y的最高正价与负价绝对值的和等于8 |
| C.化合物XY2与ZY2分子中的化学键类型相同 |
| D.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
下列物质的转化在给定条件下不能实现的是
| A.①②③ | B.②③④ | C.②③⑤ | D.①④⑤ |
下列表示对应化学反应的离子方程式正确的是
A.MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
D.NH4HCO3溶于过量的NaOH溶液中:HCO +OH-===CO +OH-===CO +H2O +H2O |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
| B.10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
| C.高温下,0.2mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA |
| D.25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
用下列实验装置进行相应实验,能达到实验目的是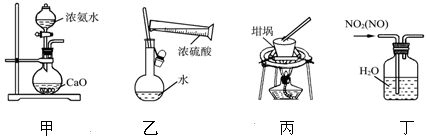
| A.用图甲所示装置制取少量的氨气 |
| B.用图乙所示装置配制一定物质的量浓度的硫酸 |
| C.用图丙所示装置从食盐水中提取NaCl |
| D.用图丁所示装置除去NO2中的NO |