设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA |
| B.10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
| C.高温下,0.2mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA |
| D.25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
体积相同的甲、乙两个容器中,分别都充有等物质的量的NH3,在相同温度下发生反应:2NH3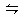 N2+3H2,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的转化率为P%,则乙容器中NH3的转化率为()
N2+3H2,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的转化率为P%,则乙容器中NH3的转化率为()
| A.=P% | B.<P% | C.>P% | D.无法确定 |
合成氨工业有下列流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为()
| A.①②③④ | B.①③②④ | C.④③②① | D.②③④① |
下列事实不能用勒夏特列原理解释的是()
| A.煅烧粉碎的硫铁矿利于SO2的生成 |
B.对2HI(g)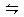 I2(g)+H2(g),增大压强可使平衡体系颜色变深 I2(g)+H2(g),增大压强可使平衡体系颜色变深 |
C.反应NO2+CO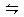 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应:N2+3H2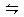 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 |
有一处平衡状态的反应2X(s)+Y(g)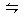 2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是()
2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是()
①升高温度;②降低温度;③增大压强;④减小压强;⑤加入催化剂;⑥及时分离出Z。
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
合成氨需要的H2由煤和水反应制得,其中一步反应为:CO(g)+H2O(g)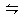 CO2(g)+H2(g)△H>0,要使CO转化率提高,可采取()
CO2(g)+H2(g)△H>0,要使CO转化率提高,可采取()
| A.增大H2O(g)的浓度 | B.增大CO的浓度 |
| C.降低温度 | D.增大压强 |