(1) 已知下列变化过程中,0.2 mol RxO42—参加反应时,共转移0.4 mol电子.
RxO+MnO4—+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2) 在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
(3)要使含a mol Al3+的A溶液中铝元素和含有b mol AlO2—的B溶液中铝元素全部转化为Al(OH)3沉淀,有________种途径,Al(OH)3的物质的量为________.(不准加固体试剂和液体试剂)
根据所学知识,完成下列要求。
(1)0.2 mol OH-的质量为,其中含有个电子;标况下L HCl气体溶于水可配成12 mol/L HCl溶液500 mL。
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明。西汉《淮南子·万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜。
在该反应中被氧化的元素是,氧化剂是;该反应的离子方程式为:。
(3)就有关物质的分离回答下面的问题。
①现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是。
②在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答:。
根据所学知识,完成下列要求。
(1)Fe2(SO4)3(写出电离方程式):。
(2)H++OH-═ H2O(写出对应的化学方程式):。
(3)氧化铜溶于盐酸(写出对应的离子反应方程式):。
(4)锌与稀硫酸反应制取氢气(写出对应的离子反应方程式):。
根据所学知识,完成下列要求。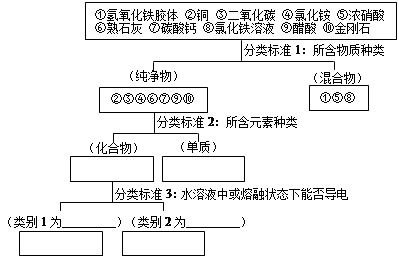
(1)上述分类方法叫做,类别1除④⑥外还有,
写出类别2的名称。
(2)①实验室制备氢氧化铁胶体的方法是:往100 mL烧杯中加入50 mL水并加热至沸腾,。
②氢氧化铁胶体和氯化铁溶液从外观上很难进行区分,下列说法正确的是_________
A.氢氧化铁胶体中胶粒直径介于1nm~100nm之间
B.两者的本质区别是氢氧化铁胶体有丁达尔效应
C.氢氧化铁胶体分散质粒子不能透过半透膜能透过滤纸
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol;
(2)该气体所含原子总数为________个;
(3)该气体在标准状况下的体积为____________L;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol/L;9.03×1023个氨分子含摩尔氢原子;个电子。