聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是 。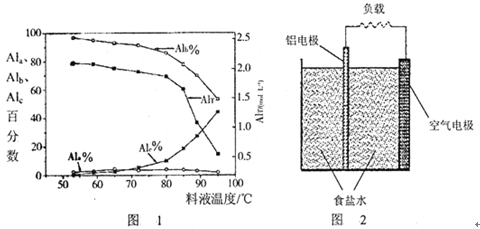
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g) △H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式 。
已知X、Y、Z三元素的质子数都小于18且依次增大,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y形成的单质是空气的主要成分,则
(1)写出元素符号:X是、Y是、Z是
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的离子
有(写出离子符号,只要写出2种)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式是
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ ______;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要属于____________。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__(填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是______________。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是,相关反应的离子方程式是。
.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 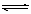 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知:K300℃>K350℃,则该反应是热反应。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2s内该反应的平均速率v=。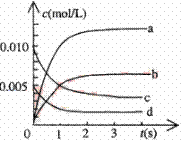
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2)d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知下列两个热化学方程式:
H2(g)+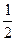 O2(g)====H2O(l)△H=-128.5kJ·mol-1
O2(g)====H2O(l)△H=-128.5kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是;
(2)已知:H2O(l) H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。
H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。