(1)下列有机物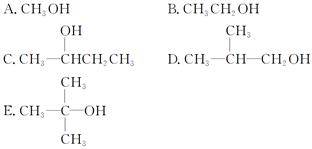
其中能被氧化成醛的有______________,不能被催化氧化的有____________,可发生
消去反应的有____________
(2)有机物A为茉莉香型香料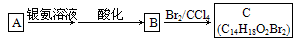
①A分子中含氧官能团的名称是____________.
②C的分子结构可表示为(其中R和R′代表不同的烃基):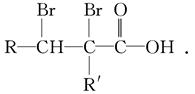
A的化学式是__________,A可以发生的反应是________________(填字母序号).
a.还原反应 b.加成反应 c.氧化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________________.
(4)A分子结构中只有一个甲基,A的结构简式是_____________________________
________________________________________________________________________.
某有机物X是农药生产中的一种中间体,其结构简式为:
(1)X的分子式为_____________________________________。
(2)X分子中含有的官能团有________(用结构简式或名称表示均可)。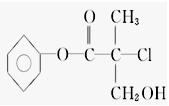
(3)X可能发生多种反应,下列有关X发生化学反应的叙述中正确的是________。
A.在氢氧化钠醇溶液中共热能发生 消去反应; 消去反应; |
| B.在铜作催化剂时加热,可被氧气氧化生成能发生银镜反应的物质; |
| C.在浓硫酸存在时加热可发生消去反应; |
| D.在铁作催化剂时,可跟液溴发生取代反应; |
(4)写出X跟氢氧化钠稀溶液共热时所发生反应的化学方程式________________。
(5)X可能有多种同分异构体,写出符合下列条件的一种同分异构体的结构简式:
。
①苯环只有分子处在对位的两个取代基。
水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):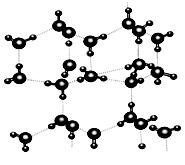
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为:。
(2)位于第四周期,与氧元素同主族的元素名称是:;其外围电子排布式是:。
(3)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是:。
| A.金刚石 | B.干冰 | C.食盐 | D.固态氨 |
(4)已知:2H2O  H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
(5)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(6)水的分解温度远高于其沸点的原因是:
________________________________________________________________________
通常状况下 ,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由同种元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由同种元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)。
a、同位素 b、同系物 c、同素异形体 d、同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子的结构式是: 。
。
②KCN溶液显碱性,原因是(用离子方程式表示):。
(5)工业上通过电解可制得X,过程中在(填“阴极”或“阳极”)产生X,每生成标准状况下33.6 L的X,转移的电子数目为。
置换反应的通式可表示为: 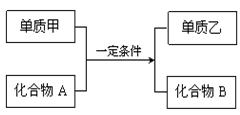
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3 Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是,A非常细,导光能力很强,可用作。
用于制作防弹背心材料的聚合物A,其结构为: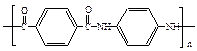 ,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案:
,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案: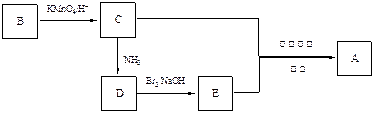
已知:
(1)写出B、D的结构简式:B、D。
(2)写出满足1H核磁共振谱的苯环上有两种氢,且能发生银镜反应的C的同分异构体(任写三个结构简式)、、。
(3)C的上述一个同分异构体F,存在下列转化:
①写出F的结构简式。
②用一个化学方程式表示由F 生成 G 和H过程中的第①步反应。
③G与C能发生缩聚反应,写出该缩聚反应的化学方程式:。