在3种有机物① CH4、② CH3CH2OH、③ CH3COOH中,属于天然气主要成分的是 (填序号,下同),俗称“酒精”的是 ,属于食醋主要成分的是  。
。
大家都知道 6月1日 是国际儿童节,但或许绝大多数人并不了解这天同时也是“世界牛奶日”。20世纪50年代,法国的促进牛奶消费协会提出了庆祝“牛奶日”的设想,并做出了每年5月第三周的周二为“国际牛奶日”的决定,2000年经联合国粮农组织(FAO)的提议,兼顾到某些国家已经确定的日期,并征得了世界700多位乳业界人士的意见,把每年的 6月1日 确定为“世界牛奶日”。人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体〔Ca 10 (PO 4 ) 6 (OH) 2 〕形式存在。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)羟基磷酸钙中钙元素的质量分数为__________(保留到 0.1 g )
(2)包装标签上脂肪≥ 3.3 g ,是指100 mL牛奶中含脂肪至少 3.3 g 。那么一盒牛奶中含钙至少__________g。(保留到 0.01 g )
有一瓶无色气体,可能含H2S、CO2、HCl、HBr、SO2中的一种或几种。将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀。据此推断:肯定有__________,肯定没有__________,无法确定的是__________。
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C 5 H 8 NO 4 Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。
某学校化学科研小组对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数。
(2)实验试剂:水、AgNO 3 溶液等
(3)实验过程:
①操作(Ⅰ)所需要的玻璃仪器有____________________。
②通过计算判断该味精中NaCl的质量分数是__________,判断该味精中NaCl__________(填“符合”或“不符合”)其包装上标注的标准。
③若溶液A的体积为50 mL,则其中NaCl的物质的量浓度为____________________。
(选考)[选修3—物质结构与性质](15分)
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_____________
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________。
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为____________。
(7)X单质的晶胞如图所示,一个X晶胞中有________________个X原子。若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为________cm(用代数式表示)
(15分)目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1〜10nm之间)。
①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2。制备纳米级碳酸钙的离子方程式为______________
②判断产品中是否含有纳米级碳酸钙的实验方法为_____________。
(2)—定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g)。将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g),其相关数据如下表所示:
CO2(g)+2H2(g),其相关数据如下表所示: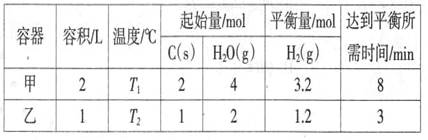
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H20(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol/LB.-1.4 mol/L
C.<1.4 mol/LD.>1.4 mol/L
③丙容器的容积为1L,t20C时,起始充入a mol C02和bmol H2(g),反应达到平衡时,测得CO2的转化率大于H2的转化率,则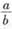 的值需满足的条件为______________;
的值需满足的条件为______________;
④丁容器的容积为1L,T10C时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B.0.6 mol、2.0 mol、O mol、O mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D.0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)CO2在一定条件下可转化为甲醚(CH3OCH3)。用甲醚燃料电池做电源,用惰性电极电解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如下图所示:
①甲醚燃料电池的负极反应式为________
②A口导出的物质为_____________________(填化学式)。
③若燃料电池通入CH3OCH3(g)的速率为0.1mol/min-1,2 min时,理论上C口收集到标准状况下气体的体积为______________