有一瓶无色气体,可能含H2S、CO2、HCl、HBr、SO2中的一种或几种。将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,产生了白色沉淀。据此推断:肯定有__________,肯定没有__________,无法确定的是__________。
已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素。请回答下列问题:
(1)①B在元素周期表中的位置________________________;
②上述元素的最高价氧化物的水化物中酸性最强的酸是________(写化学式)。
(2)C、D、E、F四种元素对应的简单离子的半径由小到大的顺序是_____(用离子符号表示)。
(3)工业上常用A、B组成的物质X来检验F的单质是否发生泄漏,有大量白烟生成,写出此反应的化学方程式______________________。其中该反应中还原剂和氧化剂的物质的量之比为_______________.
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列各问:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性.
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu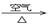 CuO
CuO 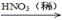 Cu(NO3)2
Cu(NO3)2
(3)①在50mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.20.16L | B.6.72L | C.10.08L | D.15.12L |
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0一定温度下,向1 L恒容密闭容器中充入5 mol SO2 和3 mol O2,反应达到平衡时有3 mol SO3(g)生成。试回答下列问题:
2SO3(g)ΔH<0一定温度下,向1 L恒容密闭容器中充入5 mol SO2 和3 mol O2,反应达到平衡时有3 mol SO3(g)生成。试回答下列问题:
(1)写出该反应的化学平衡常数表达式K =___________________。
(2)通过计算求得,该温度下,此反应的平衡常数K=________ ;SO2的平衡转化率为________ 。
(3)若降低温度,该反应K值_ (填“增大”“减小”或“不变”) ,平衡将 (填“向正反应方向”或“向逆反应方向”或“不”)移动。
(4)若保持容积不变,再向容器通入O2,再次达到平衡后,容器内SO2的浓度将 (填“增大”“减小”或“不变”)。
(5)若保持容积不变,再向容器通入SO2,再次达到平衡后,容器内2SO3的浓度将 ,SO2的转化率将 。(填“增大”“减小”或“不变”)
(6)若压缩容器体积,平衡将向 (填“向正反应方向”或“向逆反应方向”或“不”)移动。移动。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: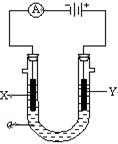
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则在X极附近观察到的实验现象是 ;Y电极上的电极反应式为 。若电解过程转移的电子为0.2mol,则X电极上产生的气体体积是 L(标准状况下)。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4 溶液,则X电极的材料是 ;Y电极的电极反应式为 。(说明:杂质发生的电极反应不必写出)
某兴趣小组采用如下方法制作氢氧燃料电池。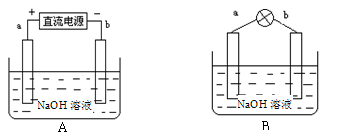
(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_______________,电解后溶液的浓度 ____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为________________________。