锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为 。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为 ,离子的空间构型是 。
(3)液氨分子间存在自耦电离:2NH3 NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
NH2-+NH4+,NH2-中氮原子轨道的杂化类型是 ,H+易与NH3形成NH4+,配位键的解释是 。
(4) 胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)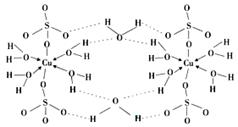
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为 ,1mol CN-中含有的π键的数目为 。
蛋白质是一类复杂的含氮化合物,每种蛋白质都有恒定的含氮量(约在14%-18%,质量分数),食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
I.蛋白质中的氮在强热和CuSO4、浓硫酸作用下,生成一种无机含氮化合物(NH4)2SO4;
II. (NH4)2SO4在凯氏定氮测定器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7;
III.用已知浓度的HCl标准溶液滴定,根据消耗的HCl量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来提高奶粉中蛋白质的含量,导致许多婴幼儿患肾结石。三聚氰胺的结构如下:
①三聚氰胺的分子式为,其中氮元素的质量分数为。
②下列关于三聚氰胺的说法中,正确的有。
| A.三聚氰胺中只含有碳、氢、氮三种元素 | B.三聚氰胺中含有苯环结构,属于苯的同系物 |
| C.三聚氰胺不是组成蛋白质的成分 | D.三聚氰胺为高分子化合物 |
③假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的奶粉中掺入多少克三聚氰胺即可使奶粉检测“达标”?
一定温度下,在容积为V L的密闭容器中进行反应:aM(g) bN(g),M、N的物质的量随时间的变化曲线如图所示:
bN(g),M、N的物质的量随时间的变化曲线如图所示: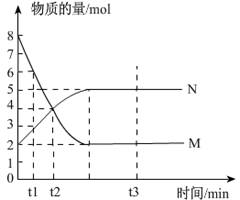
(1)此反应的化学方程式中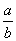 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________
(3)下列叙述中能说明上述反应达到平衡状态的是__________
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
将15.6gNa2O2与2.7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为,
该反应中的转移电子的物质的量为mol。
(2)反应结束时生成气体的体积在标准状况下为L。
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是,(用含a的代数式表示,结果可不化简)。
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C=CH CH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
根据表中数据,总结烯类化合物与溴发生加成时,反应速率与C=C上取代基的种类、个数之间的关系:。
(2)下列化合物与氯化氢加成时,取代基对反应速率的影响与上述规律类似,其中反应速率最小的是,反应速率最大的是。
A.(CH3)2C=C( CH3)2 B. CH3CH=CH CH3
C. CH2=CH2 D. CH2=CHCl
(3)今有A、B、C 3种二甲苯,将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2。A只得到一种产物,B得到两种产物,C得到三种产物。由此可以推断判断A、B、C的结构简式分别是、、。
1mol有机物能与1mol氢气发生加成反应,产物是2,2,3-三甲基戊烷,此有机物的结构简式可能有。