(7分)工业上从海水中提取溴可采用如下方法:
(1)向预先经过酸化的浓缩海水中通入Cl2,将海水的溴化物氧化,反应的离子方程式为:______________________________________。
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,生成NaBr、NaBrO3和CO2,反应的化学方程式为:______________________________________。
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂萃取溴,还可以得到副产品Na2SO4,写出这一变化的离子方程式
__________________________________________。
(4)这样得到的溴中还混有少量Cl2,怎样除去?
_________________________________________________。
(15分)碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为: 。
。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3= 。
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H______0(填“>”、“=”或“<”),理由是________________________________。
(3)根据反应时间对TON的影响图(上中图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(上右图),判断下列说法正确的是 。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
(15分)Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O ="=" BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
| 体系 pH |
不同温度下的半衰期(min) |
|||
| 0℃ |
25℃ |
50℃ |
75℃ |
|
| 8 |
4.32×100 |
6.19×10-1 |
8.64×10-2 |
1.22×10-2 |
| 10 |
4.32×102 |
6.19×101 |
8.64×100 |
1.22×100 |
| 12 |
4.32×104 |
6.19×103 |
8.64×102 |
1.22×102 |
| 14 |
4.32×106 |
6.19×105 |
8.64×104 |
1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。
温度较低时主要反应①:N2H4 + O2  N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平常数 为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气 B.增大容器体积
C.恒容条件下,充入N2H4D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
【改编】(10分)有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。

已知:(1)
(2)
请回答下列问题:
(1)写出B中官能团名称 ,PMMA的结构简式 。
(2)判断D→E的反应类型 。
(3)写出E+F→G的化学反应方程式 。
(4)写出C的一种能与新制氢氧化铜反应的同分异构体 。
【改编】[化学一选修5:有机化学基础)芳香族化合物水杨酸、冬青油、阿司匹林都是常用西药。它们的结构简式如下表:
(1)水杨酸分子中式量较大的含氧官能团名称是 。
(2)水杨酸在浓硫酸催化作用下与乙酸酐(CH3C0)20反应生成阿司匹林,反应的化学方程 。
(3)水杨酸在一定条件下可以聚合成高分子化合物聚水杨酸,聚水杨酸的结构简式为: 。
(4)写出冬青油的一种同分异构体结构简式:_____________________
异构体符合以下条件:
①芳香族化合物;
②苯环上一个氢原子被氯取代,有两种可能的产物;
③在足量氢氧化钠溶液中充分反应消耗等物质的量氢氧化钠。
(5)阿司匹林晶体中残留少量的水杨酸,可用______________(填试剂名称)检验.
实验室利用阿司匹林和水杨酸在乙酸乙酯中溶解度的差异,用结晶法提纯阿司匹林,请完成以下实验操作步骤:
①用少量热的乙酸乙酯溶解晶体.②________③经_____________操作得到纯净的阿司匹林晶体。
(6)效更佳的长效缓释阿司匹林( )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
【化学-选修3:物质结构与性质】
I.用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图1所示)可由氯化铝与氨经气相反应制得。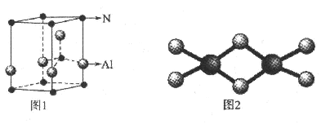
(1)基态Cr的价电子排布式可表示为__________。
(2)氮化铝的化学式为__________,距离铝原子最近且距离相等的氮原子数目为__________个。
(3)氯化铝易升华,其双聚物Al2Cl6结构如图2所示,在Al2Cl6中存在的化学键有_______________.
Ⅱ.(4)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1,下列有关N(NO2)3的说法正确的是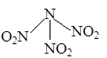
A.该物质中氮元素有两种不同的化合价
b.该物质可以归类于亚硝酸盐类化合物
c.该分子中的4个氮原子构成正四面体
d.该分子中氮原子的化学环境各不相同
(5)AlCl3在下述反应中作催化剂,分子③中碳原子的杂化类型为_____