已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
下列关系正确的是
| A.等物质的量的Na2O2与Na2O 中阴离子个数之比为2:1 |
| B.标准状况下,等体积的CO2与CO中氧原子数之比为2:1 |
| C.pH相同的H2SO4(aq)与CH3COOH(aq)中的c(H+)之比为2:1 |
| D.等浓度的(NH4)2SO4 (aq)与NH4Cl(aq)中c(NH4+)之比为2:1 |
从安全的角度考虑,下列说法不正确的是
| A.使用青霉素前,需进行皮肤敏感试验 |
| B.实验室保存苯时,应与氧化剂分开存放 |
| C.苯酚沾到皮肤上,应立即用酒精洗涤 |
| D.金属钠着火时,可用水将其扑灭 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是( )
I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是( )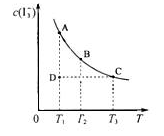
A.反应I2(aq)+I-(aq) I3-(aq)的△H<0 I3-(aq)的△H<0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.若反应进行到状态D时,一定有v正<v逆 |
| D.状态A与状态B相比,状态B的c(I2)大 |
常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的是
| A.HX和CH3COOH均可抑制水的电离 |
| B.将HCl与HX各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)="0.2" mol/L |
| C.等物质的量浓度等体积的HX与CH3COONa两溶液混合后所得溶液中: c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向等浓度等体积的HX和CH3COOH溶液中,分别加入同浓度的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者 |
下列说法中不正确的是
| A.分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有5种 |
| B.可以用酸性高锰酸钾溶液区分苯和甲苯 |
C. 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 |
| D.可用银氨溶液和碘水检查淀粉溶液部分发生水解 |