一组镍氢电池能使一台试运行的混合动力公交车两年内跑10万公里。大功率镍氢动力电池及
其管理模块,是国家“十五”863计划电动汽车重点专项中的一项重要课题。我国镍氢电池生产技
术居世界先进水平。常见的镍氢电池的某极是镍氢合金LaNi5H6(LaNi5H6中各元素化合价均为0 ),
电池反应通常表示为: 下列说法正确的是
下列说法正确的是
| A.放电时储氢合金作正极 | B.充电时储氢合金作阳极 |
| C.充电时阳极周围c(OH-)增大 | D.放电时负极反应是LaNi5H6+6OH--6e-=LaNi5+6H2O |
将0.1mol/L的醋酸钠(NaAc)溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
| A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B.c(Ac-)>c(HAc)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Ac-)=c(Cl—)>c(H+)>c(HAc) |
| D.c(Na+)+ c(H+)=c(Ac-)+ c(Cl-)+ c(OH-) |
25℃时,下列各溶液中有关物质的量浓度关系正确的是
| A.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.向NH4HSO4溶液中滴加含等物质的量溶质的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C.在0.1mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+c(SO42-) |
| D.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是
| A.分别升高温度,两种溶液的pH均减小 |
| B.相同温度下两种溶液的pH:Na2CO3> NaHCO3 |
| C.分别加入少量NaOH,两溶液中c(CO32-)均增大 |
| D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-) |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA |
| B.标准状况下,22.4 L甲苯中含C-H数目为8 NA |
| C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA |
| D.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA |
下列各选项所描述的两个量中,前者大于后者的是
| A.NH4Cl溶液中NH4+和Cl-数目 |
| B.纯水在100℃和25℃时的pH |
| C.完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积 |
D.CH3COONa溶液加水稀释前后的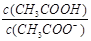 |