A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式
。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为__________________。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为_______________________________________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是____________________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) ==CO2(g)△H1<0①
途径II:先制成水煤气:C(s) +H2O(g)==CO(g)+H2(g)△H2>0②
再燃烧水煤气:2 CO(g)+O2 (g) ==2CO2(g)△H3<0③
2H2(g)+O2 (g)==2H2O(g)△H4<0④
请回答下列问题:
(1) 途径I放出的热量( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
。
(10分)在一定条件下,A和B反应可生成C和D,其能量变化如下: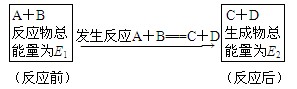
(1)下列有关反应A+B===C+D的说法正确的是。(不定项选择)
| A.反应前后原子的种类和数目一定不变 |
| B.该反应若有热量变化,则一定是氧化还原反应 |
| C.若该反应为放热反应,则不需加热反应就一定能自发进行 |
| D.反应物的总质量与生成物的总质量一定相等,且遵循能量守恒 |
(2)若E1<E2,则生成物的总能量________(填“>”、“<”或“=”)反应物的总能量,为________(填“吸热”或“放热”)反应。
能源可划分为一次能源和二次能源。自然界中以现成形式提供的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。氢气是一种高效而没有污染的二次能源,它可以由自然界中大量存在的水来制取:2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ/mol。根据以上叙述回答:
(1)下列叙述正确的是。(不定项选择)(4分)
A.电能是二次能源 B.水力是二次能源
C.天然气是一次能源 D.焦炉气是一次能源
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol,等质量的氢气和甲烷分别完全燃烧后,放出的热量之比约为( )
A.1∶3.4B.1∶1.7 C.2.6∶1D.4.6∶1
(3)关于用水制取二次能源氢气,以下研究方向不正确的是。(不定项选择)
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
| Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
| 熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
| 熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
⑴上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
;。
(2)实际应用时最常采用的(由来源和成本考虑)应该是。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。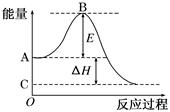
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示:_____;C点表示:(填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。