二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回收的工艺流程如下:
(1)写出第①步反应的离子方程式 。
(2)洗涤滤渣B的目的是为了除去____(填离子符号),检验该离子是否洗净的方法是 。
(3)写出第③步反应的化学方程式_____________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经 、 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为 mL。
把1.0 mol X和1.0 mol Y气体混合于2 L的密闭容器中,发生如下反应 2X(g)+Y(g)  nZ(g)+2W(g)2min末,生成0.4 mol W,以Z的浓度表示的反应速率为0.1mol/(L·min)
nZ(g)+2W(g)2min末,生成0.4 mol W,以Z的浓度表示的反应速率为0.1mol/(L·min)
(1)前2min以X的浓度表示的平均反应速率为
(2)2min末时Y的浓度为
(3)n=
在水溶液中,YO3-与S2-发生反应:YO3-+3S2-+6H+=Y-+3S↓+3H2O。
(1)此反应中,_______发生氧化反应,氧化剂是_______。
(2)YO3-中Y的化合价是_______。
(3)Y元素原子的最外层电子数是_______,它可能处于第_______族。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空: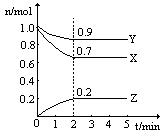
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;
(3)若X、Y、Z均为气体,反应达平衡时:
此时体系的压强是开始时的倍
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应,又能和烧碱反应;⑥F与C同主族。
用化学符号回答下列问题:
(1)用电子式表示下列物质A2C2,DCA_________________;
(2)写出E与烧碱反应的离子方程式。
(3)写出DCA与B的最高价氧化物反应的化学方程式:
。
下列关于实验现象的描述,正确的是
① 由铜锌组成的原电池,电子是从锌经过导线流向铜
② 把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③ 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④ 把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快