硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下:
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L—1,其物质的量浓度是______________________,浸出过程中反应的化学方程式是____________________________________________ 。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时,“相比”(O/A)对铜萃取率的影响如上图所示。在实际操作中“相比”应选择___________。(填序号)
A.1:1 B.1:3 C.1:5
C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O)  CuR2(O)+2H+,反萃取加入400 g·L—1 硫酸的理由是_________________________________。
CuR2(O)+2H+,反萃取加入400 g·L—1 硫酸的理由是_________________________________。
(4)从富铜液中获得较多晶体粗品的实验操作依次是___________、___________
(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的___________性质。
(14分)SO2 、CO 、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 =" -" 197 kJ•mol-1
2SO3(g) △H1 =" -" 197 kJ•mol-1
H2O(g) = H2O(l)△H2 =" -" 44 kJ•mol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 =" -" 545 kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据则x=______kJ•mol-1。
| 化学键 |
H-H |
O═O |
O-H |
| 断开1mol化学键所需的能量/kJ |
436 |
x |
463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJ•mol-1
CH3OH(g) △H=-90 kJ•mol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO (g)和2 mol H2(g) |
1 mol CH3OH(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出54kJ |
吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,则:
A点的平衡常数KA=,
B点的平衡常数KBKA。(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是(至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
则a电极名称为_______,
b电极反应式为_________________。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为,操作1为。
(2)加入H2O2的作用是(用离子方程式表示),加入氨水的作用是。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为。
为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g)∆H1="-566" kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g)∆H2="-746" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________。
(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染。原理如图所示。
电源正极为(填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为g。
合成有机玻璃树脂 和高聚物H的合成路线如下:
和高聚物H的合成路线如下:
已知:
RCOOR′+ R″OH RCOOR″ + R′OH (R、R′、R″代表烃基)
RCOOR″ + R′OH (R、R′、R″代表烃基)
CH2=CH—CH=CH2+CH2=CH2

试回答:
(1)E中官能团的名称是。
(2)C到D的反应类型是,D到E反应的“一定条件”是。
(3)下列说法正确的是(选填字母)。
| A.乙可使Br2的CCl4溶液褪色 |
| B.G与乙二醇互为同系物 |
| C.D的核磁共振氢谱有4组峰,且峰面积之比为3:1:1:1 |
| D.生成有机玻璃树脂和高聚物H均为加聚反应 |
(4)B到C的化学方程式是。
(5)乙的同分异构体中含有酯基的有种,写出其中能发生银镜反应的一种同分异构体的结构简式。
(6)生成高聚物H的化学方程式是。
废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下: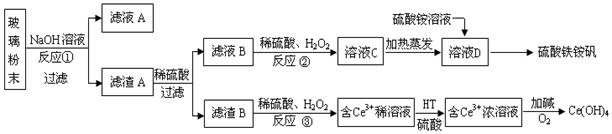
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是。
(2)反应②中H2O2的作用是。
(3)反应③的离子方程式是。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是。
(6)相同物质的量浓度的以下三种溶液中,NH4+的浓度由大到小的顺序是。
a.Fe2(SO4) 3·(NH4) 2SO4·24H2O
b.(NH4) 2SO4
c.(NH4) 2CO3