有NaCl、FeCl2、FeCl3、MgCl2、CuCl2、AlCl3、NH4Cl六种溶液, 只用一种试剂就可以把它们鉴别开来,该试剂是
| A.H2SO4 | B.NaOH溶液 | C.氨水 | D.KSCN溶液 |
基态碳原子的最外能层的各能级中,电子排布的方式正确的是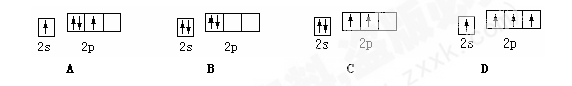
(8分)请将正确的序号填入空白处下列物质中:
属于纯净物的是________________;属于电解质的是________________;属于非电解质的是______________;属于单质的是__________________。
空气②铜③盐酸④石墨⑤乙醇⑥SO2⑦H2SO4⑧CaO⑨HCl⑩熔融的NaOH⑾ 液氨
关于氯气的叙述中,下列正确的是
| A.氯气是一种黄绿色、有毒的气体 |
| B.氯气在自然界中既可以以化合态存在,也可以以游离态存在 |
| C.氯气不能溶解于水,所以可用排水法收集氯气 |
| D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
下列溶液与20 mL 1 mol·L_1 NaNO3溶液中NO3_物质的量浓度相等的是
| A.10 mL 1 mol·L—1 Mg(NO3)2溶液 | B.5 mL 0.8 mol·L—1 Al(NO3)3溶液 |
| C.10 mL 2 mol·L—1 AgNO3溶液 | D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液 |
下列各组离子可大量共存于溶液中的是
A.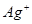 、 、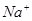 、Cl -、NO3- 、Cl -、NO3- |
B. 、 、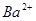 、OH-、Cl- 、OH-、Cl- |
C.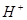 、 、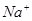 、CO32-、SO42- 、CO32-、SO42- |
D.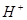 、 、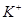 、SO42-、Cl- 、SO42-、Cl- |