请按要求填空:
(1)下列叙述完全正确的是_____________(填序号)
A、测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后在30S内跟标准比色卡比较
B、在测定硫酸铜晶体结晶水含量的实验中,下列操作都会导致测定结果偏高:①加热前称量容器时,容器未完全干燥 ②加热过程中有少量晶体溅出 ③加热后容器未放入干燥器中冷却
C、配制0.1 mol·L-1的NaCl溶液250 mL,烧杯、玻璃棒、250 mL的容量瓶、胶头滴管等玻璃仪器必须用到。
D、用50 mL酸式滴定管量取25.00 mL稀盐酸的操作可以是:先将稀盐酸注入酸式滴定管,调节其凹液面正好与25 mL刻度相切,然后将溶液全部放入50 mL锥形瓶中。
E、硝酸钾溶解度测定的实验中,温度计的水银球应处于烧杯中的水浴液面以下;分馏石油时,温度计的水银球应处于蒸馏烧瓶的支管口处。
F、仪器洗涤中常采用下列方法:①用酒精清洗制取酚醛树脂用过的大试管 ②用氨水清洗做过银镜反应的试管③用浓盐酸稍加热清洗用高锰酸钾制氧气后的试管
(2)实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D、E是常见的一些保存药品的的试剂瓶。请把下列常见的试剂的序号填写在各试剂瓶下方的括号里:
①浓硫酸②碳酸钾溶液③碱石灰④四氯化碳⑤氯水⑥浓硝酸⑦硝酸银溶液⑧金属钠
现用质量分数98%密度为1.84 g·cm-3浓H2SO4来配制450 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管
⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
⑴上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
⑵经计算,需浓H2SO4的体积为。
现有① 5 mL ②10 mL ③20 mL ④50 mL三种规格量筒,你选用的量筒是(填代号)。
⑶在配制过程中,下列操作错误的是(填代号),
其他操作都准确,下列操作能引起误差偏高的有(填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
实验室可利用乙醇、铜或铜的化合物制备乙醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是;
(2)两套装置中的A、B处都需加热,
A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(3)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,
B中反应的化学方程式为。
(4)若按乙装置进行实验,则B管中应装,
B中反应的化学方程式为。
(5)实验结束后,将C试管中的溶液滴入新制的氢氧化铜溶液中并加热,可观察到的
现象,写出该过程的化学方程式。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2d. NaOH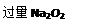
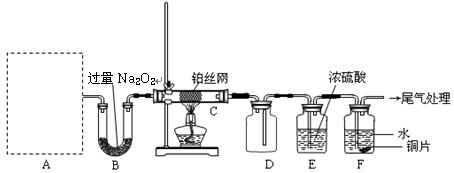
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是(填代表备选试剂的字母);此时A中主要的玻璃仪器有(填名称)。
(2)A中产生的物质被B中 Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:。
Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:。
(3)对于C中发生的可逆反应,下列说法正确的。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。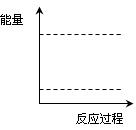
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是mol,甲在标准状况下体积为L(忽略气体溶解)。
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) ▲。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。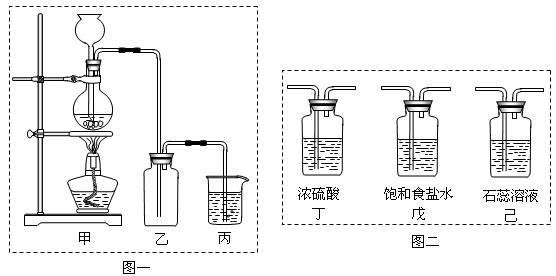
(1)指出图一装置中的错误之处 ▲, ▲
(2)丙装置的作用 ▲。丙装置中发生反应的离子方程式 ▲。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: ▲。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
▲。
| A.NaBiO3 | B.FeCl3 | C.PbO2 | D.Na2O2 |
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
▲。为什么? ▲。
实验室配制480 mL 0.1mol·L-1 NaOH溶液,回答下列问题
(1)应用托盘天平称取氢氧化钠固体▲g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、▲。
(3)若实验遇下列情况,则所配溶液的物质的量浓度是 A、偏高 B、偏低 C、不变(用符号回答)
①定容时俯视刻度线▲;
②放在滤纸上称量NaOH固体 ▲。
(4)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去(标签如图)。