第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需要的能量。下表是部分元素原子的第一电离能I1:(单位)
| H |
|
|
|
|
|
|
He |
| 1.3120 |
|
|
|
|
|
|
0.3723 |
| Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 0.5203 |
0.8995 |
0.8001 |
1.0864 |
1.4023 |
1.3140 |
1.6810 |
2.0807 |
| Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
| 0.4958 |
0.7377 |
0.5776 |
0.7865 |
1.0118 |
0.9996 |
1.2511 |
1.5205 |
| K |
Ca |
Ga |
Ge |
As |
Se |
Br |
Kr |
| 0.4189 |
0.5898 |
0.5788 |
|
0.9440 |
0.9409 |
1.1399 |
1.3507 |
| Rb |
Sr |
In |
Sn |
Sb |
Te |
I |
Xe |
| 0.4030 |
0.5495 |
0.5583 |
0.7086 |
0.8316 |
0.8693 |
1.0084 |
1.1704 |
| Cs |
Ba |
Tl |
Pb |
Bi |
Po |
At |
|
回答下列问题:
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是 。说明同一主族元素 能力从上到下逐渐增强。
(2)从表中数据预测Ge元素第一电离能I1的最小范围 。
(3)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为两个中心重合,各面分别平行的两个正方体,其中心为Si原子,试在小正方体的顶点画出与Si最近的C(用 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。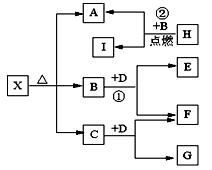
试回答下列问题
(1)X的化学式为:;G的电子式为。
(2)写出下列反应的化学方程式
①②。
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为,电解质溶液为。
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H克,有关化学方程式为。
美日三名化学家[理查德·赫克(Richard Heck,美)、根岸荣—(Ei – ich Negishi,日)、铃木章(Akira Suzuki,日)利用钯(Pd)作催化剂,将有机化合物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为(R – X中的R通常是不饱和烃基或苯环;R′CH=CH通常是丙烯酸酯或丙烯腈等):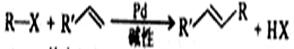
现有A、B、C、D等有机化合物 有如下转化关系:
有如下转化关系: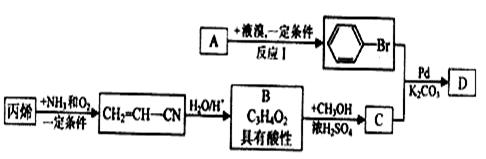
请回答下列问题:
(1)反应I的化学方程式为。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加 氢的化学方程式:。
氢的化学方程式:。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为
。
(4)写出B转化为C的化学方程式:。
(5)D的结构简式为。
(6)D具有化学性质有(填编号)。
A.加热能与氢氧化钠溶液反应
B.能使溴的四氯化碳溶液褪色
C.能发生缩聚反应和加聚反应
D.能使酸性高锰酸钾溶液褪色
(7)已知:醛基直接与苯环连接的醛如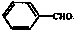 不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式:。
不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式:。
①波谱分析显示分子中没有甲基;
②1,3,5—三取代苯;
③具有酸性,既能与Fe3+作用显色,又能使溴水褪色,易被新制的氢氧化铜氧化
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。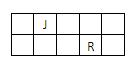
(1)元素T的名称是
(2)J和氢元素组成的化合物A每个分子由4个原子组成,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是
(3)工业燃烧焦炭后的尾气中含有M和R组成的气体,为了测定其含量,可以选择的试剂是
| A.氢氧化钠溶液 | B.硫酸酸化的高锰酸钾溶液 | C.淀粉碘化钾溶液 | D.溴水溶液 |
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
(5)由L和M组成的两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
(6)与J同主族的另一短周期元素和M组成的化合物有很广泛的用途,请说出其主要应用,写出两种。
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)_______;
此时,混合溶液中由水电离出的c(H+)___ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点______________;C点_____ ________;
________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、 F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
I.写出下列物质的化学式:
A__________________;H _______________; G_____________;乙______________;
II.写出下列反应的化学方程式
反应①_________________________________________________________________
反应②_________________________________________________________________