某有机物X(C4H6O5)广泛存在于许多水果内,尤其以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:①1 molX与足量金属钠反应产生1.5 mol气体;②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应。根据上述信息,对X的结构判断正确的是
| A.X中含有碳碳双键 | B.X中含有三个羟基和一个-COOR |
| C.X中含有一个羧基和两个羟基 | D.X中含有两个羧基和一个羟基 |
同学们在做铜与浓硝酸反应的实验时,发现反应后溶液里绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中不可行的是
| A.加水稀释绿色溶液,观察颜色变化 |
| B.加热该绿色溶液,观察颜色变化 |
C.向该绿色溶液中通 入氮气,观察颜色变化 入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
元素的原子结构决定其性质和周 期表中的位置。下列说法正确
期表中的位置。下列说法正确 的是
的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较远的区域内运动的电子能量较低 |
| C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| D.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(气)+B(气)  xC(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
xC(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
| A.只能为2 | B.只能为3 | C.可能是2,也可能是3 | D.无法确定 |
铜锌原电池(如图)工作时,下列叙述正确的是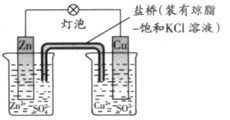
A 正极反应为:Zn—2e-=Zn2+ B电池反应为:Zn+Cu2+=Zn2+ +Cu
C 在外电路中,电流从负极流向正极 D 盐桥中的K+移向ZnSO4溶液
用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为 ( )
| A.13 | B.12 | C.8 | D.1 |