万州中学初三一班的学生为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验,请你与他们一起完成以下探究活动。
【对固体猜想】Ⅰ:全部是NaOH;Ⅱ:全部是Na2CO3;Ⅲ: 。
【查阅资料】经查阅资料可知,常见的盐溶液中,Na2CO3溶液显碱性,CaCl2溶液显中性
【实验和推断】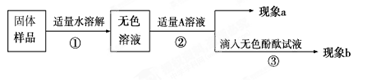
(1)向无色溶液中加入A溶液,现象a为有气泡产生,则A溶液是 ,说明氢氧化钠已经变质。
(2)由(1)可知氢氧化钠已经变质,重新取适量的无色溶液,加入足量的A(CaCl2溶液)除去Na2CO3,请写出这二者反应的化学方程式 ,当实验现象 (提示:现象a和b),则猜想Ⅲ成立。
小亮同学想通过实验探究某企业采用的氨碱法制的的纯碱样品的成分及含量。
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
(1)只含有
;(2)含有
【查阅资料】
|
|
|
|
| 加入稀盐酸 |
现象Ⅰ |
产生气泡 |
| 加入饱和石灰水 |
溶液变浑浊 |
现象Ⅱ |
| 加入CaCl2溶液 |
无明显现象 |
溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 |
澄清石灰水变浑浊 |
澄清石灰水无明显变化 |
(1)表中的现象Ⅰ为;
(2)现象Ⅱ对应的化学方程式为。
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小列实验报告。
| 实验步骤 |
实验现象 |
|
| ①取少量样品溶于水,加入过量的CaCl2溶液。 |
; |
该反应的方程式。 |
| ②将上述反应后的混合液过滤,取滤液。 |
; |
证明猜想②成立。 |
【实验反思】
实验步骤①中,氯化钙溶液过量的目的是。
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了下图装置,通过称量
装置懂得质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置
均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有 ①;
①;
②。
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:
①检查装置气密性,将
干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的
瓶质量;
③打开活塞
,从导管
处缓缓鼓入一定量的空气,关闭活塞
;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡
⑤再次称量盛有氢氧化钠浓溶液的
瓶质量;
⑥打开活塞
,从导管
处缓缓鼓入一定量的空气,关闭活塞
;
⑦根据
瓶增加的质量,计算样品中各成分的含量。
该实验的正确步骤是。
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:"测定水的组成还有其他的方法吗?"经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。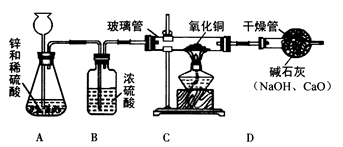
[设计方案]甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置
中发生反应的化学方程式为,洗气瓶
中浓硫酸的作用为
[实验探究]当玻璃管中固体由黑色转变为红色时,实验测得:
①装置 的玻璃管和其中固体的总质量在反应后减少了 ;
②装置
的干燥管和其中物质的总质量在反应后增加了
,用此数据算得水中
、
元素的质量比为,而由水的化学式算得
、
元素的质量比为。
[分析交流]针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是(假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
[意外发现]丙同学不小心将反应后的少量红色固体
洒落到多量稀硫酸中了,发现除了有红色固体
以外,溶液的颜色由无色变为蓝色。
[提出问题]铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
[查阅资料]①
被还原的过程中会有
生成,
也能被还原在
② 固体是红色的,它一稀硫酸的反应为: .
[得出结论]红色固体
中含有
。
[分析交流]红色固体
中含有
是否会影响水组成的测定结果(填"影响"或"不影响")。
[提出猜想]针对红色固体
的成分,小组同学提出猜想①是:
和
;猜想②是:。
[拓展探究]丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体
和玻璃管的总质量,完全反应后,你认为他还需要称量的质量。
[教师点拨]称取一定质量的红色固体
与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
[定量分析]小组同学再次实验,他们开始称取质量为
的红色固体a,与足量的稀硫酸完全反应后得到红色固体
为
。假如
红色固体
都是
,请你计算出生成铜的质量(利用
.进行计算,写出计算过程);然后,通过与实际得到的固体
进行比较,判断猜想成立(填①或②)。
小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】
猜想①
、
猜想②
、
、
猜想③
、
、
猜想④
、
猜想⑤
上述猜想中,你认为不合理的是猜想(填序号)。
【实验探究】⑴小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是(填"合理"或"不合理")的,理由是。
⑵小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝。该反应的化学方程式是。
【实验结论】根据上述实验探究,你认为猜想(填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是(答一点即可)。
某实验小组开展了如下有关碱的化学性质探究活动: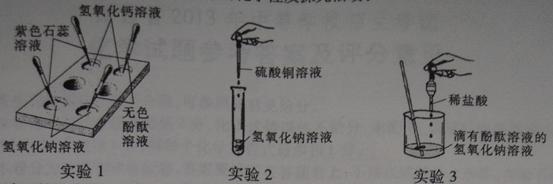
(1)买验l的目的是;
(2)实验2中发生反应的化学方程式是;
(3)实验3中观察到溶液由红色变为无色后,小萍想知道反应后溶液中除
外,是否还含有其他溶质(不考虑酚酞),于是她向反应后的溶液中加入一种试剂,从而得出了结论。
小萍加入的试剂可能是;
(4)通过上述实验探究活动,可以总结出碱的化学性质是:
①碱能与酸发生中和反应(精校);
②;
…………
(5)准备实验时,小英发现药品室有两瓶未标注浓度的氢氧化钠溶液,经询问老师得知,该两瓶溶液的溶质质量分数分别为5%和l0%。请你设计实验方案完成对这两瓶溶液的鉴别(仅限以下实验用品:试管、量筒、滴管、酚酞溶液、10%盐酸)。
| 实验步骤 |
预计现象及相应结论 |
| 为5%的氢氧化钠溶液,另一种为l0%的氢氧化钠溶液。 |
小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。
【猜想】猜想l:可以减少汽车尾气的污染;
猜想2:可以产生更多的热量,增强汽车的动力。
【诒计与实验】
| 序号 |
实验步骤 |
实验现象 |
结论 |
I |
在两个蒸发皿中各加入lOmL 冷水,控制相同燃烧条件,分别用 乙醇和汽油作为燃料进行加热,记 录从开始加热到水沸腾的时间。 |
用乙醇加热耗时118s; 用汽油加热耗时56s。 |
猜想2 (填"成立"或 "不成立"); |
Ⅱ |
实验l停止加热后,取下蒸发 皿,观察蒸发皿的底部。 |
用乙醇加热的蒸发皿底部 只有极少量炭黑,而用汽油加热 的蒸发皿底部有大量炭黑。 |
(可仿照上格填写) |
【分析与讨论】
(1)实验I是一个对比实验,实验过程中不一定要控制的条件是(填序号);
A.水的初始温度必须相同B.加热开始计时点必须相同
C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将;
(3)目前乙醇汽油中乙醇的添加量约为10%.可一定程度节省石油资源。结合实验I的结论分析,如果乙醇的添加量过大,会使汽车动力(填"增强"、"减弱"或"不变")。