a g Fe粉与一定量的硝酸在一定条件下充分反应,将生成的气体与标准状况下b L  混合,恰好能被水完全吸收,则a和b的关系可能是
混合,恰好能被水完全吸收,则a和b的关系可能是
| A.b>0.3a | B.b<0.2a | C.0.2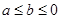 .3a .3a |
D.无法确定 |
用下图所示实验装置进行相应实验,能达到实验目的的是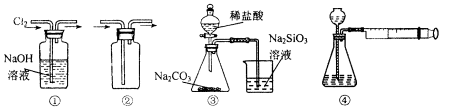
| A.装置①可用于除去Cl2中含有的少量HCl气体 |
| B.按装置②所示的气流方向可用于收集H2、NH3等 |
| C.装置③可证明非金属性Cl>C>Si |
| D.装置④向左推动针筒活塞可检验该装置的气密性 |
下列关于电化学的叙述正确的是
| A.图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 |
| B.图②装置可以验证牺牲阳极的阴极保护法 |
| C.图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH- |
| D.分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
原子序数依次递增的 4 种短周期元素可形成简单离子,W2-、X+、Y3+、Z2-,下列说法不正确的是
| A.工业上常采用电解法冶炼Y 单质 |
| B.气态氢化物的稳定性: H2W强于H2Z |
| C.离子半径由大到小:、Z2->X+>Y3+>W2- |
| D.W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
下列有关海水综合利用的说法中,不正确的是
| A.用氯气从海水中提溴的关键反应是:Cl2+2Br—=2Cl—+Br2 |
| B.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| C.海水中的Na+、Cl—结晶成NaCl的过程,形成了化学键 |
| D.从海水中可以得到氯化镁,再经过电解可制金属镁 |
高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→FeO+Cl-+H2O(未配平),下列有关说法不正确的是
| A.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| B.高铁酸钾中铁显+6价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为3∶2 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |