(16分)现有A、B、C、D、E可溶于水的五种化合物,其组成的离子如下表,且每种离子只有一次。
| 阳离子 |
Ag+ Na+ Fe3+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- SO32— NO SO42— |
某同学将它们分别配成0.1 mol·L-1的溶液,进行操作,发现如下实验现象:
①C溶液显黄色,其它溶液均为无色溶液。
②已知向B、C、D、E溶液分别加入A溶液均产生白色沉淀;
③B溶液与适量E溶液反应生成白色沉淀,加入过量E溶液,白色沉淀量减少,但不完全消失。
(1)据此推断它们的化学式:
A__________;B__________;C________;D________;E________。
(2)B溶液加入少量E溶液的离子方程式____________________________________。
(3)向C溶液滴加少量的D溶液的离子方程式_________________________________。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是_________________
(2)①的反应类型是________________,③的反应类型是________。
(3)反应③的化学方程式是:___________________________________________。
(4)反应④的化学方程式是:___________________________________________。
(1)在下面元素周期表中全部是金属元素的区域为。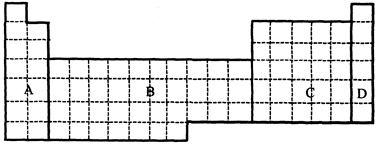
(a)A (b)B (c)C (d)D
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍;Y元素单质为双原子分子,其氢化物水溶液呈碱性;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况);W元素原子核外M层电子数目比K层多1个;
①请写出元素X的一种核素的化学符号;
②写出元素Y在周期表中的位置;
③Z、W两元素相比较,金属性较强的元素是(填元素符号),可以验证该结论的实验是。
(a)比较两种元素单质的熔点
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)比较这两种元素的最高价氧化物对应水化物的碱性
(d)比较这两种元素的气态氢化物的稳定性
图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
| 元素编号 |
A |
B |
C |
D |
E |
| 电负性 |
3.0 |
2.5 |
X[ |
1.5 |
0.9 |
| 原子半径(单位nm) |
0.099 |
0.102 |
0.110 |
0.143 |
0.186 |
| 主要化合价 |
-1,+7 |
-2,+6 |
-3,+5 |
+3 |
+1 |
请回答下列问题:
(1)写出E元素的离子结构示意图;
(2)X的值应为(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
下列六种物质中①Ar ②CO2 ③NH4Cl ④KOH ⑤Na2O2 ⑥MgCl2请回答:
(1)只存在共价键的是;(填写序号)
只存在离子键的是;(填写序号)
不存在化学键的是 。(填写序号)
(2)Na2O2的电子式为;
(3)KOH溶于水,破坏了;氯化铵受热分解破坏了。
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图。请回答: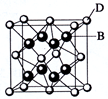
(1)A的元素符号是_____
(2)B与A形成的化合物比C 与A形成的化合物沸点高,其原因是_____
(3)E元素名称是;它的+2价离子的电子排布式为_____
(4)从图中可以看出,D跟B形成的离子化合物的化学式为;在晶体中与D距离最近且相等的B有个, D跟B形成的离子化合物的熔点D跟C形成的离子化合物的熔点(填“>”或“<”)。