小强在实验室里做实验时,拿出一瓶久置的氢氧化钙粉末,进行如下实验:
(1)取氢氧化钙粉末溶于足量水中,有_______________现象出现,小强判断该药品已变质。
(2)小强进一步做如下实验探究,请你参与并完成下表:
| 实验操作步骤 |
实验现象 |
实验结论 |
|
| 取样、加适量的水,搅拌,过滤。 |
①取少量滤渣于试管中,加入_____ |
有气泡产生 |
粉末变质 |
| ②取少量滤液于试管中,滴入______溶液。 |
________________ |
氢氧化钙粉末部分变质。 |
小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她
设计并完成了下表所示的探究实验:
| 实验操作 |
实验现象 |
实验结论或总结 |
||
| 结论 |
总结 |
|||
| 实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有气泡产生,木条不复燃 |
过氧化氢分解产生氧气,但是。 反应的化学方程式为: 。 |
二氧化锰是过氧化氢分解的催化剂 |
| 实验二 |
向盛水的试管中加入二氧化锰,伸入带火星的木条 |
没有明显现象 |
||
| 实验三 |
二氧化锰能加快过氧化氢的分解 |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是:。
一般情况下,金属越活泼,与酸反应速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(如图所示):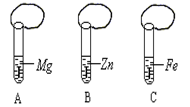
实验步骤:
①取A、B、C三支试管,分别加入2 mL浓度相同的盐酸溶液
②分别加入足量的、大小相等的Mg、Zn、Fe立即把三个相同
的气球分别套在各试管口上。实验预测与分析:
(1)写出锌与盐酸反应的化学方程式:_________________ ________。
(2)气球膨胀速度最快的是______________。(填试管编号)
(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是_。
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之间应该:________
(16分)小明知道二氧化锰能作过氧化氢分解的催化剂后,再想探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
(1)[问题]氧化铝能不能作过氧化氢分解的催化剂呢?
(2)[猜想]氧化铝能作过氧化氢分解的催化剂。
他设计并完成了下表所示的探究实验: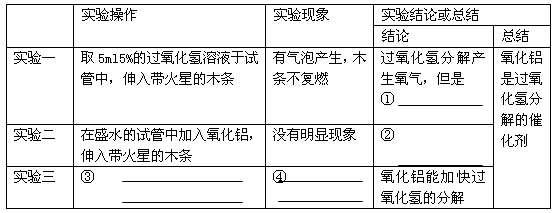
(1)请你帮助小明同学填写上表中未完的表格。
(2)在小明的探究实验中,实验一和实验二起的作用是______;
(3)[讨论与反思]经过讨论,有的同学认为只有上述两个证据,不能证明氧化铝能作过氧化氢分解的催化剂,还要补充两个方面的探究实验,最终大家一起完成了对这个猜想的验证。
第一方面的实验操作中包含了两次称量,其目的是______
第二方面的实验是利用实验三反应后试管内的剩余物继续实验。接下来的实验操作是______现象和结论为______
元旦联欢会上,化学老师给同学们表演了一个“水能生火”的魔术(如图所示),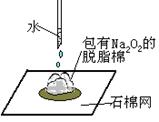
他将包有过氧化钠(Na2O2)粉末的脱脂棉放在石棉网上,向棉花上滴了几滴水,棉花立刻燃烧了起来。同学们产生了浓厚的兴趣,为什么脱脂棉会燃烧起来呢?
【提出猜想】
a.小明认为过氧化钠(Na2O2)与水反应生成了可以支持燃烧的物质。
b.小刚又根据燃烧的条件,对小明的猜想进行了补充:。
【实验与分析】同学们设计了图的实验装置。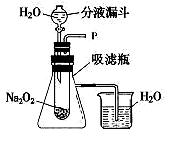
(1)打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到木条复燃,你推测此气体可能是。
(2)实验中还观察到,烧杯中的导气管口有气泡冒出,产生这一现象的原因是。
(3)完成了以上实验,老师介绍该反应的产物一共有两种,于是同学们又展开了进一步的研究,继续探究反应后生成的另一种物质。请你回答:另一种产物必含的元素是________,依据是_____________。
【老师介绍】过氧化钠不仅可以和水发生反应,也可以和二氧化碳反应,也能生成氧气。因此,过氧化钠经常被用于潜水艇和防毒面具中提供氧气。
【补充实验】
明确了以上性质,小芳同学又设计了一个实验(如图):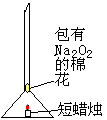
将一团包有过氧化钠的粉末的棉花塞到漏斗的管中,漏斗下方点燃一支短蜡烛 (蜡烛火焰与棉花不接触)。
请回答:
棉花 (填“能”或“不能”)燃烧。这主要是因为蜡烛燃烧生成能与过氧化钠(Na2O2)反应的物质___________________,同时反应放热。
物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?
小刘、小李按下面的步骤进行探究:
(1)提出假设:物质发生化学变化前后总质量不变。
(2)设计并进行实验:小刘设计实验装置和选用药品如A所示,小李设计实验装置和选用药品如B所示,他们在反应前后都进行了规范操作、准确的称量和细致的观察。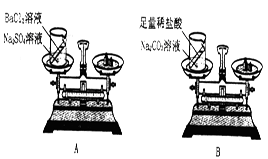
①这两个实验所发生的化学反应方程式为:
小刘的实验:BaCl2+Na2S04=BaS04↓+2NaCl
小李的实验:
②实验结论:
小刘认为:在化学反应中,生成物的总质量与反应物的总质量相等;
小李认为:在化学反应中,生成物总质量与反应物总质量不相等。
③你认为的结论正确,导致另一个实验结论错误的原因是:
④请从原子的角度分析你认为正确的结论的原因:
⑤使用上述实验装置,请你选择另外两种药品进行实验达到实验目的,这两种药品可以是(填化学式)[注:以上四种药品均不能再用]