一般情况下,金属越活泼,与酸反应速度越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(如图所示):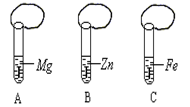
实验步骤:
①取A、B、C三支试管,分别加入2 mL浓度相同的盐酸溶液
②分别加入足量的、大小相等的Mg、Zn、Fe立即把三个相同
的气球分别套在各试管口上。实验预测与分析:
(1)写出锌与盐酸反应的化学方程式:_________________ ________。
(2)气球膨胀速度最快的是______________。(填试管编号)
(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是 _。
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之间应该:________
根据下图所示装置回答问题(装置图用序号表示):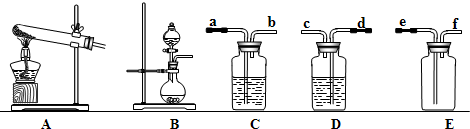
(1)双氧水(H2O2)是一种无色液体,可发生如下反应:2H2O2 2H2O + O2↑,在实验室利用此反应制取氧气时,应选用的气体发生装置是。
2H2O + O2↑,在实验室利用此反应制取氧气时,应选用的气体发生装置是。
(2)实验室用大理石和盐酸反应制取二氧化碳,在生成的气体中常混有少量氯化氢和水蒸气,C装置用于除掉水蒸气,可选用做干燥剂(填名称)。利用D装置除掉氯化氢时,选择的试剂是饱和NaHCO3溶液,已知NaHCO3与HCl反应生成NaCl、H2O、CO2,请写出该反应的化学方程式。
(3)将制取二氧化碳的装置按发生、净化和收集的顺序进行连接,生成的气体通过净化装置导管口的先后顺序是(填导管接口序号)。
如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题: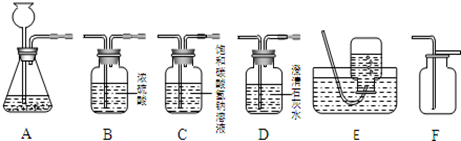
(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体,(提示:盐酸中会挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为(填写仪器序号字母)。
②生成二氧化碳时,所发生反应的化学方程式为。
(2)收集CO2时,他们如何检验已CO2收集满?
(3)实验室制取气体要选择适当反应物.我们知道实验室制取大量CO2气体不能用浓盐酸,因为。
(4)他们对实验室制取CO2的实验条件展开了进一步的探究,做了如下四个对比实验:
①取mg块状大理石与足量的溶质质量分数为5%的盐酸反应;
②取mg块状大理石与足量的溶质质量分数为10%的盐酸反应.
实验现象:产生气泡的快慢顺序为②>①;
实验结论:影响大理石和盐酸反应快慢的因素有;
你认为影响大理石和盐酸反应快慢的因素还有。
(14分)将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组欲对蓝色固体的成分进行探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由:(用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈(填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,化学反应方程式分别为:
Cu(OH)2==CuO+H2O CuCO3==CuO+CO2
③无水CuSO4遇水变蓝色。
(三)设计与实验:
Ⅰ.固体的获取:
将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
Ⅱ.用下图所示装置,定性探究固体的成分。
(1)若用装置A、B组合进行实验,B中无现象,则猜想正确;
(2)若用装置A、C组合进行实验,C中无现象,则猜想正确;
(3)小组同学将装置按 A、、(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的;实验中: C中的现象。
结论:固体为Cu(OH)2和CuCO3的混合物。
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量变化与分解温度的关系如下图,请根据图示回答下列问题:
(4)根据图示从A点到达B点时的固体质量差,求被分解的氢氧化铜的质量(写出计算过程)。
(5)通过计算可得32.0g固中C元素和H元素的质量比=。
(6)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:。
7分)某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体。 为确定产生的气体和白色固体的成分,该同学进行了如下的探究。
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无现象,则该气体为 。
(2)对白色固体做出如下猜测并进行实验:
【猜想假设】①白色固体可能是Mg(OH)2;
②白色固体可能是MgCO3;
③白色固体可能是。
【查阅资料】①:Mg(HCO3)2能溶于水; ②:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
③:碱石灰主要成分是NaOH和CaO的混合物。
【进行实验】
| 操作 |
现象 |
结论 |
| 取洗净后的白色固体,加入足量的 |
观察到 |
白色固体一定含有MgCO3 |
| 秤取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 |
碱石灰增重,浓硫酸不变 |
【反思评价】其他同学认为上述结论不正确,原因是 。改进方法是 。
制作馒头时常加入泡打粉,在制作过程中由于产生二氧化碳气体,使馒头变得松软可口。小明对泡打粉的发面原理产生兴趣,进行了以下实验探究。
【查阅资料】
泡打粉是一种复合膨松剂,又称为发泡粉,可作为快速发面剂用于制作面食。某种泡打粉的主要成分是小苏打粉和酒石酸氢钾。
【提出问题】泡打粉为什么会产生二氧化碳气体?
【猜想】
猜想1:小苏打受热分解产生二氧化碳气体
猜想2:酒石酸氢钾受热分解产生二氧化碳气体
猜想3:小苏打和酒石酸氢钾在溶液中发生反应,产生二氧化碳气体
【实验探究】小明利用以下实验装置进行探究
装置1装置2
| 序号 |
实验方案 |
实验现象 |
实验结论 |
| Ⅰ |
在装置1的a试管中放入小苏打,加热 |
a试管口内壁有无色液滴,_________。 |
b试管中发生反应的化学方程式为______。 猜想1正确 |
| Ⅱ |
在装置1的a试管中放入酒石酸氢钾,加热 |
a试管口内壁有无色液滴,石灰水不变浑浊 |
______________ |
| Ⅲ |
在装置2的c试管中放入小苏打和酒石酸氢钾的混合物,滴加________。 |
, 石灰水变浑浊 |
猜想3正确 |
【实验反思】
(1)通过以上实验探究,小明又查阅到碳酸氢钠分解的反应为: 2NaHCO3  Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。
Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。
(2)通过以上实验探究,下列关于泡打粉的说法中,正确的是_______.
A.泡打粉保存时要注意防潮
B.使用泡打粉前不需要将面进行发酵
C.用纯碱替代泡打粉能起到完全相同的效果
D.泡打粉在加水揉面与蒸馒头的过程中均能起到发面作用