某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号) ,该错误操作会导致测定结果 (填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应 :判断滴定终点的现象是 。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果 (填“偏大”、“偏小”或“无影响’')。
(3)按正确操作测得有关数据记录如下: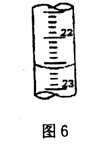
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
20.38 |
| 第二次 |
20.00 |
4.00 |
24.20 |
| 第三次 |
20.00 |
2.38 |
a |
①a的读数如图6所示,则a= ;
②烧碱样品的纯度为 % 。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置:
实验中所用的某些试剂及产物的相关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
||
| 乙醇 |
-114 |
78 |
||
| 乙酸 |
16.6 |
117.9 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
||
| 98%H2SO4 |
10 |
338 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从__ __口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
(10分)将5.6 g Fe加入到100 mL的稀硫酸中溶液中,恰好完全反应。
(1)写出该反应的化学方程式,并标出电子转移方向和数目。
(2)试求生成气体在标准状况下的体积和稀硫酸的物质的量浓度。
(3)计算反应中转移的电子数目。
某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示。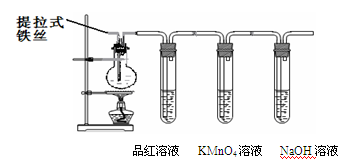
①在烧瓶中加入浓硫酸。
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象。
③加热烧瓶至有大量气体 产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色。
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
由步骤②的现象可得出的结论是:
在步骤③中,品红溶液褪色的原因是
写出步骤④中,使溶液变为浅绿色的可能的原因是(用离子方程式表示);
(4)KMnO4溶液褪色的化学方程式。
(5)设计实验证明反应后的溶液中只有Fe2+(答操作和现象)
(6)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是(用含a、b数学表达式表示)
(10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol・L-1的盐酸和0.1mol・L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol・L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol・L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol・L-1盐酸和0.1mol・L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。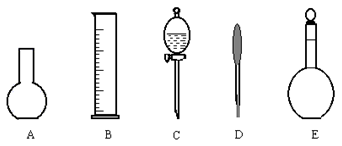
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
(4)写出有关的化学方程式_____________________。
某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写)。
(2)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高”“偏低”或“不变”)。
(3)判断到达滴定终点的实验现象是。