某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示。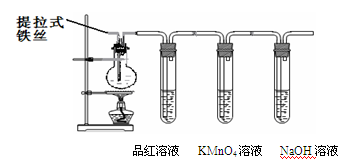
①在烧瓶中加入浓硫酸。
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象。
③加热烧瓶至有大量气体 产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色。
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
由步骤②的现象可得出的结论是:
在步骤③中,品红溶液褪色的原因是
写出步骤④中,使溶液变为浅绿色的可能的原因是 (用离子方程式表示);
(4)KMnO4溶液褪色的化学方程式 。
(5)设计实验证明反应后的溶液中只有Fe2+ (答操作和现象)
(6)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是 (用含a、b数学表达式表示)
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。现有一红色粉末可能含有Fe2O3和Cu2O中的一种或两种,设计合理的实验探究样品中Fe2O3、Cu2O的存在。
查阅数据知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
请完成以下实验探究过程:
(一)提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是__________________;
假设3:红色粉末是___________________。
(二)设计实验方案
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是_________________________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______________。简述你的理由________________________。
(3)若固体粉末完全溶解,向所得溶液中滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是_______________。写出实验过程中发生反应的离子方程式________________、_______________、__________________。
(4)若经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为_______。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)______________.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________,____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______________.
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)____________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_____________,请设计实验检验所得溶液中溶质的阴离子______________.
常温下有浓度为0.1mol/L、体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应。根据图像回答下列问题:
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 |
溶质化学式 |
溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) |
① |
>7 |
| ② |
③ |
=7 |
| ④ |
NH4Cl |
⑤ |
(2)该温度时氨水的电离平衡常数K数值约为____________。滴定过程中所用盐酸的pH=____________。
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为____________ moI/L。
(1)某课外活动小组同学用图1装置(M、N为外电源的两个电极)进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的_________腐蚀。请写出正极反应式:____________。
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为__________极(填“阴”或“阳”),该电极上发生的电极反应式为_____________,总反应的离子方程式为________________。
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
①B出口导出的气体是__________,制得的氢氧化钠溶液从出口____________(填“A”、“B”、“C”或“D”)导出。通过阴离子交换膜的离子数____________(填“>”、“<”或“=”)通过阳离子交换膜的离子数。
②氢气、氧气和氢氧化钠溶液又可制成燃料电池,该电池的负极反应式为__________________。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
①甲烷燃料电池负极的电极反应为________________________。
②闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________(填化学式),电解氯化钠溶液的总反应方程式为_________________________;
③若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为__________(法拉第常数F=9.65×104 C · mol-1,列式计算),最多能产生的氯气体积为__________L(标准状况)。