碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀pH |
6.0 |
7.5 |
1,4 |
| 沉淀完全pH |
13 |
14 |
3.7 |
(1)氯酸钠的作用是 ;
(2)调节溶液A的pH范围为 ,可以选择的试剂是 .(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是 ;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是 。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式: 。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净 。
铜是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响,请完成下面的题目。
在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式: _________________________________________________。
(2)铜器表面有时会生成铜绿Cu2(OH)2CO3,Cu2(OH)2CO3也可写成Cu(OH)2·CuCO3,它有Cu(OH)2和CuCO3的化学性质,这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
钛(Ti)因为具有神奇的性能越来越引起人们的关注,是航空、军工、电力等方面的必需材料,被誉为“空间金属”和“深海金属”。
(1)钛和钛的合金具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是________。
| A.用来做保险丝 | B.用于制造航天飞机 |
| C.用来制造人造骨 | D.用于制造船舶 |
(2)常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。地壳中含钛矿石之一称金红石(TiO2),目前大规模生产钛的方法是:
第一步:金红石、炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式:______________________,该反应的还原剂是 ________________________________________________________________________。
第二步:在氩气的气氛中,用过量镁在加热条件下与TiCl4反应制得金属钛。
简述由上述所得产物中获取金属钛的步骤____________________。
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现象 |
| 1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
| 5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
| 6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)______;在电化学腐蚀中,负极反应是__________________________;正极反应是____________________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是_____________________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是________________。(答两种方法)
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3―→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。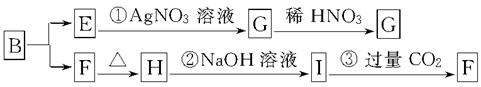
请回答下列问题:
(1)写出化合物B和化合物G的化学式______________、______________。
(2)A可能所属的晶体类型是________,在A晶体中,每个显正价原子周围结合的另一种原子的个数是________。
(3)写出反应②的离子方程式:____________________。
(4)写出C经隔绝空气高温分解得到A的化学方程式:________________。
(5)分析反应③,你能得出的结论是__________________________________________(合理即可)。
单晶硅是现代信息基础材料。工业上,硅是在电炉中用炭粉还原二氧化硅制得的。
(1)若往电炉里加入二氧化硅和炭粉的混合物,通电,使它们发生如下反应生成硅:2C+SiO2 2CO↑+Si
2CO↑+Si
从保护生态环境和建设节约型社会等方面来说,在该生产环节中需要注意的主要问题是________________________________________________________________________
________________________________________________________________________。
(2)以上生产所得到的硅不纯,称为“粗硅”。一些高新技术产品的元件中使用的硅是极其纯净、几乎没有任何缺陷的单晶硅。
①工业上,硅的提纯原理为在加热下让粗硅与氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅。请写出上述过程中有关反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
②实验室中,将细沙粉(SiO2)与镁粉混合加热,也可制得粗硅。这种粗硅往往含有过量的镁、氧化镁和硅化镁(Mg2Si),这些杂质可用盐酸除去(提示:Mg2Si与盐酸反应的产物之一是SiH4)。请写出在实验过程中所发生的氧化还原反应的化学方程式
________________________________________________________________________
________________________________________________________________________。