能够证明甲烷构型是四面体的事实是
| A.甲烷的四个键键能相同 | B.甲烷的四个键键长相等 |
| C.甲烷的所有C-H键键角相等 | D.二氯甲烷没有同分异构体 |
相同条件下,现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
| A.由水电离出的c(H+):①=②=③=④ |
| B.将②、③溶液混合后,pH=7,消耗溶液的体积:③ >② |
| C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
为了使反应2HCl+2Ag =2AgCl +H2↑能顺利进行,某同学设计了下列四个实验,如下图所示,你认为可行的是
右图为阳离子交换膜法以石墨为电极电解饱和硫酸钠溶液的原理示意图。已知Na2SO4溶液从A口进料,含少量NaOH的水从B口进料,据图分析,下列说法不正确的是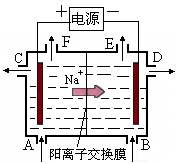
| A.阳极的电极反应式为4OH--4e-= 2H2O+O2↑ |
| B.从E出口逸出的气体是H2 |
| C.从D出口流出的是较浓的NaOH溶液 |
| D.电路中转移4 mol电子时,阳极区有1 mol H2SO4生成 |
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
下列叙述正确的是
| A.Y为CuSO4溶液 |
| B.正极反应为Cu-2e-= Cu2+ |
| C.在外电路中,电流从Cu极流向Ag极 |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池 |
反应相同
下列反应的离子方程式正确的是
| A.石灰乳与Na2CO3溶液混合: Ca2++CO32-=CaCO3↓ |
| B.向FeI2溶液中通入过量Cl2: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| C.氯气通入氢氧化钠溶液中: 2Cl2+2OH-=3Cl-+ClO-+H2O |
| D.钠与水的反应: Na+2H2O =Na++2OH-+H2↑ |