有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B____,D。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该
化合物化学式为____。
(3)C常用作净水剂,用离子方程式表示其净水原理________。
(4 )在A溶液中加入少量澄清石灰水,其离子方程式为____。
)在A溶液中加入少量澄清石灰水,其离子方程式为____。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0 .78g沉淀,
.78g沉淀,
则E溶液的物质的量浓度可能是moI·L-1
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:①Cl2→Cl+Cl②Cl+H2→HCl+H③H+Cl2→HCl+Cl……反应②中形成的化合物的 电子式为 ;反应③中被破坏的化学键属
电子式为 ;反应③中被破坏的化学键属 于键(填“极性”或“非极性”)。
于键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是(用元素符号表示)。与氯元素同周期且金属性最强的元素 位于周期表的第
位于周期表的第 周期族。
周期族。
( 3)卤素单质及化
3)卤素单质及化 合物在许多性质上都存在着递变规律。下列有关说法正确的是。
合物在许多性质上都存在着递变规律。下列有关说法正确的是。
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小
c.卤化 氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为▲,
金属X是▲,固体A的化学式▲,操作②包含的步骤有蒸发浓缩、▲、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称▲,需要测定的数据有▲。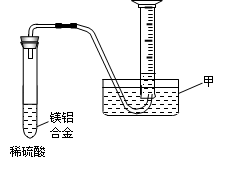
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为▲mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。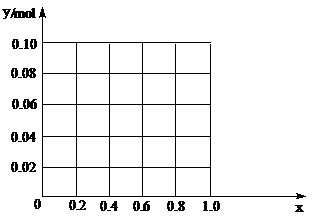
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,请按要求回答下列问题。
(1)金属A元素在周期表的位置是,G的化学式是___________。
(2)写出反应“C→F”的离子方程式;
(3)写出反应“I→J”的离子方程式;
(4)写出金属 H与水蒸气在高温下反应的化学方程式。
(Ⅰ)A、B、C在一定条件下,有如下转化关系:
请根据上图回答:
(1)写出①的反应类型
(2)C中所含官能团的名称是
(3)分别写出②、④反应的化学方程式(有机物用结构简式表示):
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。
请填写下列空白:
(1)试剂A的名称为,X的结构简式为。
(2)操作①是。
(3)写出甲苯和溴乙烷的混合物中加入试剂A时发生反应的方程式。