电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq) 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1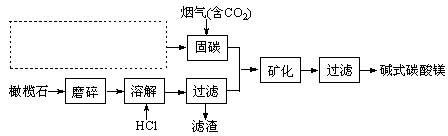
(1)某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
(2)固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应能自发进行的原因是 。
(3)请在上图虚框内补充一步工业生产流程 。
(4)下列物质中也可用作“固碳”的是 。(填字母)
a.CaCl2 b.H2NCH2COONa c.(NH4)2CO3
(5)由图可知,90℃后曲线A溶解效率下降,分析其原因 。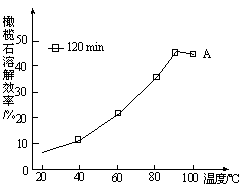
(6)经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是 。
某烃能使KMnO4溶液褪色,但不能使溴水褪色,其分子式为C8H10,该烃的一氯代物有三种(含侧链取代物),该烃的结构简式是_____________;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为_______或________。
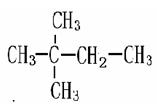
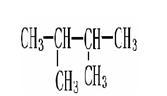
下列物质中互为同系物的有,互为同分异构体的有,
互为同素异形体的有 ,属于同位素的有, 是同一种物质的有。
⑴液氯
⑵ 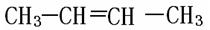
⑶白磷⑷氯气⑸氯水
⑹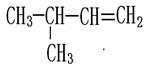 ⑺红磷⑻3717Cl
⑺红磷⑻3717Cl
⑼ 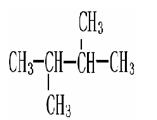
(10)
⑾3517Cl
(12)
在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ,现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为
(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
Na3N是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)该化合物所形成的晶体类型属于________
(2)写出Na3N与水反应的化学方程式:_________________________________
(3)Na3N放入足量的盐酸中可以生成两种盐,其化学式分别为__________和__________
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: