(16分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是____________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):_______________。
(3)上述反应中,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_______________________________________________________________________。
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH 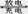 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: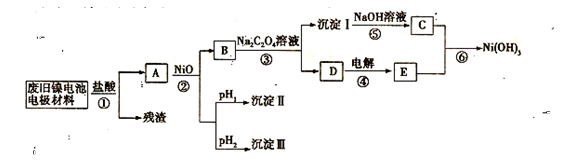
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)x |
Ksp |
pH |
|
| 开始沉淀 |
沉淀完全 |
||
| Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
| Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
| Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是。
(5)④中阳极的电极反应为,验证阳极产物的试剂为。
(6)试写出⑥的离子方程式。
(18分)在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右: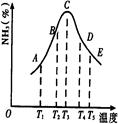
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式为。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3产率的有(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
E.加入催化剂 F.吸收NH3 G.通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
(8分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
⑴其中操作正确的同学是________。
⑵证明有Fe(OH)3胶体生成利用的胶体性质是________。
⑶在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带__________(填“正”或“负”)电荷。
②若向其中加入饱和Na2SO4溶液,产生的现象是。
③若向其中加入浓盐酸溶液,产生的现象是。
(4)Fe(OH)3胶体制备的化学方程式为。
(8分)现有Ca(OH)2、Na2CO3、BaCl2、NaOH、盐酸、稀硫酸六种溶液,它们存在如图所示的相互反应关系,图中每条线两端的物质可以发生化学反应,试回答下列问题:
⑴写出下列物质的化学式:A、C、D、F;
⑵写出下列反应的离子方程式:A+B、
E+F。
根据方程式:Ba(OH)2+(NH4)2SO4 BaSO4↓+2NH3↑+2H2O,请回答:
BaSO4↓+2NH3↑+2H2O,请回答:
⑴(NH4)2SO4属于,H2O属于 ___。(填字母)
A、电解质 B、非电解质 C、胶体
⑵写出(NH4)2SO4的电离方程式: _____ _。
⑶写出该反应的离子方程式: ___。E