硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是( )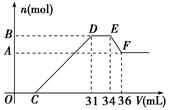
| A.合金与硝酸反应时硝酸过量 |
| B.合金中铝的物质的量为0.008 mol |
| C.合金中金属的物质的量共为0.032 mol |
| D.无法求出C点的值 |
室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的一元弱碱的溶液浓度一定比pH=2的一元强酸溶液浓度大
B.浓度均为0.1mol/L的硫酸氢钠溶液与氢氧化钠溶液等体积混合后:c(Na+)=2c(SO42-)=0.2mol•L-1
C.H2C2O4为二元弱酸,浓度为0.1 mol/L的Na2C2O4溶液中: c(Na+) =2c(C2O42-) +c(HC2O4-) + c(H2C2O4)
D.浓度均为0.l mol/L的NaHSO3溶液和NaHCO3溶液中(R表示S或C):c(H+)<c(RO32-)+c(OH-)
向NaHCO3和Na2CO3的混合液中逐滴加入Ba(OH)2溶液。下列离子方程式与事实不符的是
| A.OH-+HCO3-+Ba2+→BaCO3↓+H2O |
| B.CO32-+Ba2+→BaCO3↓ |
| C.2OH-+2HCO3-+Ba2+→BaCO3↓+CO32-+H2O |
| D.OH-+HCO3-→H2O+CO2 |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A的结构如图。下列关于A的相关叙述正确的是
| A.A在酸性条件下可以发生水解反应 |
| B.1mol A和足量NaOH溶液反应,最多消耗9mol NaOH |
| C.A能和浓溴水发生加成和取代反应 |
| D.A含4种官能团 |
下列实验操作正确且能达到预期目的的是
| 实验目的 |
操作 |
|
| A |
证明二氧化硫漂白性 |
将二氧化硫通入溴水,溴水褪色 |
| B |
证明碳酸酸性强于苯酚 |
在苯酚钠溶液中通入二氧化碳,溶液变浑浊 |
| C |
除去苯中混有的苯甲酸 |
加入氢氧化钠溶液,振荡静置分液 |
| D |
比较锌铜金属活泼性 |
用导线连接两个石墨电极,放入ZnSO4、CuSO4的混合液 |
向80mL 0.1mol•L-1稀HNO3溶液中加入铜粉和铁粉混合物,固体完全溶解,在反应后溶液中滴加硫氰化钾溶液,溶液没有出现血红色。铜粉和铁粉混合物的质量可能是
| A.0.168g | B.0.184g | C.0.192g | D.0.200g |