向80mL 0.1mol•L-1稀HNO3溶液中加入铜粉和铁粉混合物,固体完全溶解,在反应后溶液中滴加硫氰化钾溶液,溶液没有出现血红色。铜粉和铁粉混合物的质量可能是
| A.0.168g | B.0.184g | C.0.192g | D.0.200g |
1928年,苏联按照国家计划在乌拉尔地区建设两个钾矿矿井,一个由苏联自主建设,另一个由德国公司负责。这反映出苏联在工业化初期
| A.缺少基本的技术基础 |
| B.突破了计划经济指令的制约 |
| C.依赖外资建设重工业 |
| D.采取新经济政策的某些做法 |
“吾国纱厂事业,自欧战起后,获利甚厚,国人鉴于利之所在,均争相投资,设厂增锭,大有风起云涌之概。迨欧战告终,本纱之输出杜绝,外纱复纷至沓来,遂致连年市价,一蹶不振。”据此判断,第一次世界大战后中国棉纺织业“一蹶不振”的原因有
①世界棉纺织业渐超趋萎缩
②西方列强经济侵略
③官僚资本挤压民族企业
④商人投资规模过度
| A.①③ | B.②④ | C.①④ | D.②③ |
博物、物理、化学等自然科学课程从清末开始列入中学课程。下图显示中学自然科学课程比重的演变情况。据此,下列表述正确的是
自然科学课程比重趋势图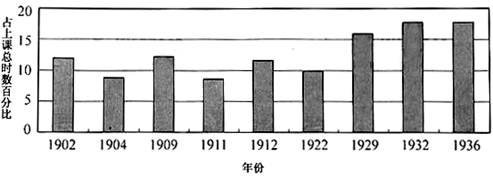
(注:1922年始专指高级中学自然科学课程)
| A.1902年自然科学课程的设置标志着中国教育近代化的启动 |
| B.1922年自然科学课程比重体现了“五四”时期科学思潮兴起 |
| C.1929~1936年自然科学课程比重表明国民政府重视科学教育 |
| D.自然科学课程比重的变化反映了清末民国时期轻视人文教育 |
在20世纪20年代浙江上虞县的下管村,“生产上它是一个农业社会,……下管人除粮食和菜蔬肉类等还能自给自足,并有毛竹和茶叶等山货可以外销外,日常生活的工业品,几乎全是外来的‘洋货’。……除了制造和修理农具和家具的一些手工业外,家庭纺织业等已被淘汰殆尽。”据此可知,近代以来下管村自然经济瓦解的征象是
| A.毛竹和茶叶等山货的外销 |
| B.农具等制造业和修理业的存在 |
| C.粮食和菜蔬肉类等的生产 |
| D.纺织和部分土产加工业的淘汰 |
马克思主义经典作家指出,“尽管有这些(关税)保护措施,大工业仍使竞争普遍化了,大工业创造了交通工具……把所有的资本都变成为工业资本,从而使流通加速、资本集中”;“它首次开创了世界历史,因为它使每个文明国家以及这些国家中的每一个人的需要的满足都依赖于整个世界”。对此最恰当的理解是
| A.关税保护阻碍不了资本主义竞争 |
| B.工业革命促进了世界市场的形成 |
| C.交通工具扩大了工业文明的影响 |
| D.自由竞争增强了工业资本的流通 |