(15分)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。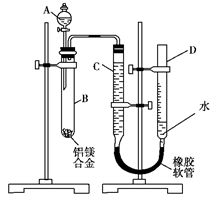
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是______________
___________________________________________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应__________________ 。
(4)B中发生反应的化学方程式为__________________________ 。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 。(填“偏大”、“偏小”、“不受影响”)
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为 g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:镁铝合金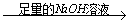 充分反应后测定剩余固体质量
充分反应后测定剩余固体质量 g
g
实验设计2:镁铝合金 生成的气体在标准状况下的体积为VL。
生成的气体在标准状况下的体积为VL。
请回答以下问题:
实验设计1:
(1)镁的质量分数:。
(2)在溶解、过滤中使用的玻璃仪器有 __________。
(3)过滤后洗涤沉淀的操作方法是________________________________________
____________________________________________________。
(4)如果过滤得到沉淀没有用蒸馏水洗涤数次后,烘干,再测定剩余固体质量。测得镁的质量分数量会(填“偏大”、“偏小”或“无影响”)。
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(2)确定含有乙烯的现象是_________________________________________________。
给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极的反应式为_______。
b电极的反应式为_________。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_________________
现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。
请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有(填代号)。
(2)经计算,需浓硫酸的体积为;
现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填代号)
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒。转移完毕,用少量蒸馏水洗涤烧杯和2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度cm处,改用滴加蒸馏水到与刻度线相切。塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签。
(4)在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有(填代号)。
①转移前,容量瓶中含有少量蒸馏水
②定容时,加蒸馏水超过标线,又用胶头滴管吸出
③定容时,俯视刻度线
④定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
实验题:某学生为了验证氢气还原氧化铜的产物,设计了下图所示的实验装置。
⑴ 写出编号仪器的名称: ①______________
⑵ 写出A中反应的离子方程式_____________________________
⑶ 浓H2SO4的作用是_____________________
⑷ 本实验需要加热的装置为____________(填字母编号)。
⑸ 写出装置C、D中可观察到的现象:C______ ___,D_________
⑹ D中反应每生成1mol水分子,转移的电子数为____________个。