现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________________mol。
(2)该气体所含原子总数为________________个。
(3)该气体在标准状况下的体积为_________________L。
(4)该气体在标准状况下的密度为_______________ g/L。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为;
(2)SO42-的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42-互为等电子体的分子的化学式:;
(3) 向CuSO4溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是。
(5)CuS比CuO的熔点(填高或低),原因是。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2•12H2O,其工艺流程图如下: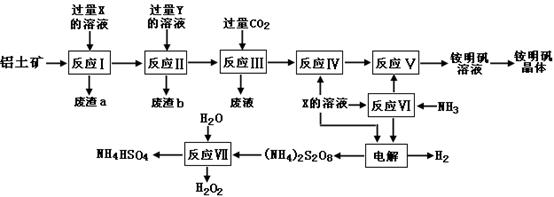
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:____________________________。
(5)反应Ⅶ的化学方程式为:______________________________________;
NH4HSO4溶液中离子浓度由大到小顺序为:___________________________。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
(1)制备氢氧化铁胶体的化学方程式为。
(2)碳酸氢钠在水溶液中的电离方程式为。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是(填选项字母)。
HSO3-+OH-水解平衡的事实是(填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是(填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是(填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:。
| 物质 |
A |
B |
C |
D |
| 起始投料/mol |
2 |
1 |
2 |
0 |
某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
(1)煅烧过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式:。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2-+ 2H2O Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_________。
Al(OH)3+ OH-。“浸取”时应保持溶液呈________性(填“酸”或“碱”),“浸取”时不断搅拌的目的是_________。
(3)“转化”时加入NaOH的主要作用是(用离子方程式表示)_________。
(4)上述工艺中可以循环利用的主要物质是________、________和水。
化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: (g)
(g)
 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式。该反应的化学平衡常数K=(用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请
画出t1之后的正逆反应曲线,并作出标注。
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)="0.04" mol/L,则该温度
下Ksp(Ag2SO4)=。(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。该电解池阳极材料是(写化学式);阳极的电极反应式为__ _________。