已知:H2(g)+F2(g) === 2HF(g) ΔH =-270 kJ·mol-1,下列说法正确的是
| A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
已知X、Y为同周期元素,且电负性X>Y,则下列说法错误的是()
| A.X与Y形成化合物时,X显负价,Y显正价 |
| B.第一电离能可能X>Y,也可能X<Y |
| C.最高价含氧酸的酸性:X<Y |
| D.气态氢化物的稳定性:Y<X |
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是()
A.分子中可能所有的原子共面
B.1mol EGC与4mol NaOH恰好完全反应
C.能发生氧化反应、取代反应和加成反应
D.遇FeCl3溶液生成紫色沉淀
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是()
| A.X2YZ4 | B.XYZ3 | C.X3YZ4 | D.X4Y2Z7 |
将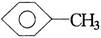 和
和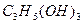 (甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是()
(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是()
| A.40% | B.35% |
| C.30% | D.无法计算 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是()
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4] 2+不会与乙醇发生反应 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |