1 mol/L H2SO4的含义是
| A.1L水中含有1mol H2SO4 | B.1L溶液中含有1mol H+ |
| C.1L H2SO4溶液中含98g H2SO4 | D.将98g H2SO4溶于1L水配成溶液 |
某有机物分子式为CaHbOcNd,则氢原子数目b最多为
| A.2a + d + 2 | B.2a + 2d + 2 | C.2a + c + d | D.2a + c + 2 |
有X、Y、Z、W四种金属。已知X的最高价氧化物的水化物的碱性比Y的强;X3+可使Z氧化;W可与热水反应产生H2,X不能与热水反应;把X的金属片插入稀H2SO4中,让金 属丝Z与X接触,则X的溶解速率加快
属丝Z与X接触,则X的溶解速率加快 。这四种金属活动性强弱关系一定是:
。这四种金属活动性强弱关系一定是:
| A.Y>X | B.Z>Y | C.W>Z | D.Z>X |
哈伯因发明了由氮气和氢气 合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是
合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生,有关说法正确的是
N2+3H2 2NH3
2NH3
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲 线如图所示,下列描述正确的是
线如图所示,下列描述正确的是
A.反应开始到10  s,用Z表示的反应速率为 0.158 mol·L-1·s-1
s,用Z表示的反应速率为 0.158 mol·L-1·s-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D .反应的化学方程式为:X(g)+ Y(g)
.反应的化学方程式为:X(g)+ Y(g)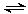 Z(g)
Z(g)
将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.产生气泡的速度甲比乙慢 |
| D.两烧杯中溶液的pH均增大 |