科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的。已知在25℃,105 Pa时,1 mol石墨和1 mol一氧化碳完全燃烧生成二氧化碳时的放热分别是ΔH=-393.5 kJ/mol和ΔH=-283 kJ/mol,下列说法或方程式正确的是
| A.在相同条件下:2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ/mol |
| B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ |
| C.在相同条件下,C(石墨,s)+CO2(g)===2CO(g) ΔH=+172.5 kJ/mol |
| D.已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
下列实验装置和操作能达到实验目的的是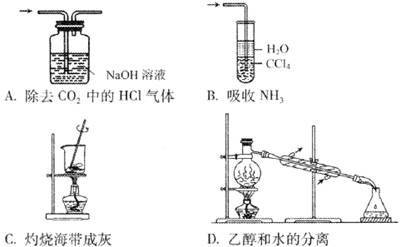
四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍。则下列说法中正确 的是
| A.原子半径比较:X<Y<Z<W |
| B.X的氢化物沸点一定低于Y的氢化物 |
| C.Y的氢化物稳定性一定弱于W的氢化物 |
| D.短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
下列选项中的数值前者小于后者的是
| A.25℃和l00℃时H2O的KW |
| B.同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) |
| C.同温同浓度的NaHCO3溶液和CH3COONa溶液的pH |
| D.中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
有机物蒽的结构简式为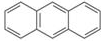 ,它的二溴代物的同分异构体的数目为
,它的二溴代物的同分异构体的数目为
| A.13 | B.14 | C.15 | D.16 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO42- |
| B.无色溶液中:K+、Ca2+、Cl-、NO3- |
| C.使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3- |
| D.使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- |