设C+CO2 2CO DH>0 ,反应速率为V1;N2+3H2
2CO DH>0 ,反应速率为V1;N2+3H2 2NH3 DH<0,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
2NH3 DH<0,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
| A.同时增大 | B.同时减少 |
| C.V1增大,V2减小 | D.V1减小,V2增大 |
下列关于金属的保护的说法中正确的是
| A.以铝为阴极极,可以在铝表面生成一层致密的氧化膜 |
| B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| C.生铁(铁碳合金)比纯铁耐酸能力更强 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是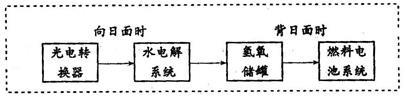
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
下列说法正确的是
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.钢铁发生电化腐蚀的正极反应式:Fe-2e- = Fe2+ |
右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是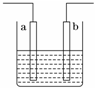
| A.a、b不可能是同种材料的电极 |
| B.该装置可能是电解池,电解质溶液为稀盐酸 |
| C.该装置可能是原电池,电解质溶液为稀盐酸 |
| D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸 |