物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液②Cu与FeCl3溶液③Zn与H2SO4溶液④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
C、CO、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、110.5 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是
A. C B. CO C. CH4 D. C2H5OH
直接提供电能的反应一般是放热反应,下列反应中能提供电能的是
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.氢氧化钠与稀盐酸反应 |
| C.灼热的炭与CO2反应 | D.H2与Cl2燃烧反应 |
有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
| A.d、a、b、c | B.b、a、d、c | C.d、b、a、c | D.d、c、a、b |
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是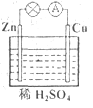 B
B
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn -2e-=Zn2+ ④Cu2+在溶液中由Cu棒向Zn棒迁移
| A.①② | B.①②③ | C.②③④ | D.①②③④ |