用NA表示阿伏加德罗常数,下列说法正确的是
| A.0.2 mol Na2O2与CO2完全反应转移的电子数为0.4 NA |
| B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA |
| C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA |
| D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA |
下列叙述正确的是()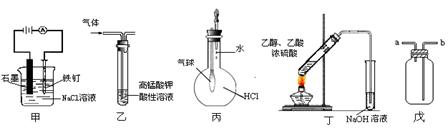
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊既可用于收集H2、CO2、Cl2和HCl气体,也可用于干燥H2、CO2、Cl2和HCl气体。
| A.①⑤ | B.④⑤ | C.①② | D.③⑤ |
有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种微粒,分别属于同一个氧化还原反应中的反应物和生成物,下列叙述错误的是()
| A.氧化剂与还原剂的物质的量之比为8:1 |
| B.还原产物为NH+4 |
| C.若有l mol NO-3参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-=Fe3+ |
下表中有关离子方程式的评价合理的是()
| 选项 |
化学反应及离子方程式 |
评价 |
| A |
AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ |
错误,铝元素的产物应该是AlO2﹣ |
| B |
过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 |
正确 |
| C |
用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O |
正确 |
| D |
氯化铵溶于水: NH4+ + 2H2O == H3O+ + NH3·H2O |
错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
下列叙述正确的是 ()
| A.0.1 mol·L-1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
| B.常温下,在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+可能大量存在 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终产物是()
| A.Fe(OH)2、Al(OH)3、NaCl |
| B.Fe(OH)2、Al(OH)3、NaAlO2、NaCl |
| C.Fe(OH)3、NaAlO2、NaCl |
| D.Fe(OH)3、Al(OH)3、NaAlO2、NaCl |