A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子电子层数:A<B B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D D.最高价氧化物对应的水化物碱性:C<D
已知As、Br位于同一周期。下列关系中正确的是
| A.原子半径:As>C1>P | B.热稳定性:HC1>AsH3>HBr |
| C.还原性:As3->S2->C1- | D.酸性:H3AsO4>H2SO4>H3PO4 |
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.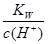 <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)=c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2c(CO32-) |
| D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) |
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是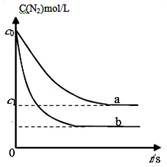
A.温度T下,该反应的平衡常数K= 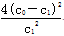 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
碘与氢气反应的热化学方程式是
① I2(g) + H2(g)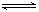 2HI(g) △H=-9.48 kJ·mol-1
2HI(g) △H=-9.48 kJ·mol-1
② I2(s) + H2(g) 2HI(g)△H=+26.48 kJ·mol-1
2HI(g)△H=+26.48 kJ·mol-1
下列说法正确的是
| A.①的产物比②的产物稳定 |
| B.I2(s)= I2(g)△H= +17.00kJ·mol-1 |
| C.②的反应物总能量比①的反应物总能量低 |
| D.1 mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ |
下列物质中不会因见光而分解的是()
| A.NaHCO3 | B.AgNO3 | C.HClO | D.HNO3 |