工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
⑴气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
⑵用稀H2SO4 浸泡熔渣B,取少量所得溶液,检验溶液中还存在Fe3+的方法是_______________________(注明试剂、现象)。
⑶由泡铜冶炼粗铜的化学反应方程式为__________________________________。
⑷以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是____________。
a.阴阳极的质量变化相等 b.电解质溶液的组成不发生变化
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
⑸利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________________________________________。
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图: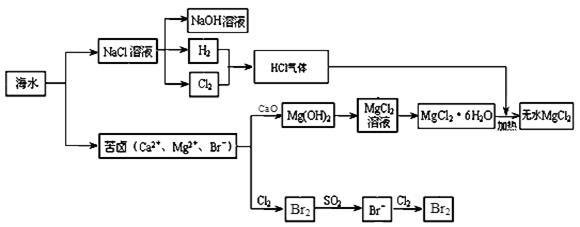
回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、____(填试剂化学式),然后____(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是 。
(5)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出。最后再用H2SO4处理得到Br2,最后一步反应的离子方程式是__________ 。
(10分) A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A 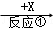 B
B 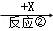 C
C
试回答:
(1)若X为O2,则A不可能是 (填选项).
a.Sib.NH3c.Mgd.S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因 ,举出C的一种用途 .
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式 ,C的水溶液中各离子浓度由大到小顺序为 .
高纯度锰酸锂(LiMn2O4)是锂电池重要的正极材料。
(1)工业上有一种制取高纯度锰酸锂的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生的化学反应方程式:________。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750 ℃共热5 h,得到锰酸锂。请写出发生的化学反应方程式:_________。
(2)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。
把分析纯碳酸锂与球形二氧化锰两种粉末,按物质的量1:4混合均匀加热。
①升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低得多。原因是________。
②升温到566 ℃时,产生另一种气体X,X恰好与CO2物质的量相等,同时得到固体B。请写出发生的化学反应方程式:_________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式:_________。
用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是____________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是______,产品K2CO3中最可能含有的杂质是__________(写化学式)。
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量浓度/mol·L-1 |
溶液的密度/g·cm-3 |
|
| 硫酸 |
c1 |
ρ1 |
| 氨水 |
c2 |
ρ2 |
(1)配制480 mL 1 mol·L-1的硫酸溶液用到的基本实验仪器除玻璃棒、烧杯外,还有________。
(2)质量分数为w1的硫酸与水等体积混合,所得溶液的质量分数______ w1/2(填“大于”“小于”或“等于”,下同)。
(3)物质的量浓度为c2 mol·L-1的氨水与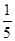 c2 mol·L-1的氨水等质量混合,所得溶液的密度____ρ2 g·cm-3,所得溶液的物质的量浓度______
c2 mol·L-1的氨水等质量混合,所得溶液的密度____ρ2 g·cm-3,所得溶液的物质的量浓度______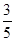 c2mol·L-1(混合后溶液的体积变化忽略不计)。
c2mol·L-1(混合后溶液的体积变化忽略不计)。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50 mL 1 mol/L的硫酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到多少克固体?