下列离子方程式与所述事实相符且正确的是
A.用惰性电极电解熔融氯化钠:2Cl—+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
| B.向偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
| D.向碳酸氢钙溶液中加入足量的氢氧化钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列表示物质结构的化学用语或模型正确的是( )
| A.8个中子的碳原子的符号:12C | B.NaCl的电子式: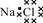 |
C.Cl—的结构示意图: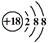 |
D.CH4分子的比例模型: |
下列变化过程中表示的能量转化关系错误的是 ( )
| A.植物光合作用:光能→生物质能 | B.电灯发光:电能→化学能 |
| C.木柴烧饭:生物质能→热能 | D.太阳能热水器:光能→热能 |
19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是()
| A.提出了原子学说 | B.发现了元素周期律 |
| C.提出了分子学说 | D.制定了科学完整的元素周期表 |
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是()
A.原子最外层电子数:B<A
B.B与E可以形成EB2型化合物
C.A与E形成的化合物中含有离子键
D.最高价氧化物对应的水化物碱性:C<D
向4.0 L容器中充入0.70 mol SO2和0.40 mol O2 , 4 s末测得剩余SO2 0.30 mol,则v(O2)为( )
| A.0.10 mol·L-1·s-1 | B.0.025 mol·L-1·s-1 |
| C.0.50 mol·L-1·s-1 | D.0.0125 mol·L-1·s-1 |