单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉: a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
— |
— |
— |
| 升华温度/℃ |
— |
180 |
300 |
162 |
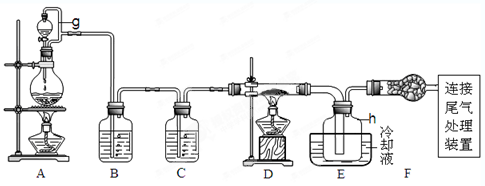
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式: ;
②滴定前是否要滴加指示剂? (填“是”或“否”),判断滴定终点的方法是 。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响 (填“偏高”、“偏低”、或“无影响”)
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有 溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题:
溶液的棉花。给试管加热,观察现象。当反应一段时间以后,停止加热。回答下列问题: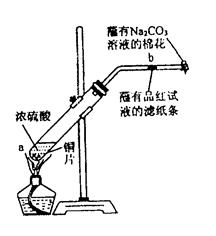
(1)写出a处反应的化学方程式,
浓硫酸所体现的作用是性。
(2)试管中的液体反应一段时间后,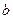 处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)待试管中液体冷却后,取试管上层液体加入一支试管中,再慢慢加入少量水,可观察溶液呈色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是
(5)如果浓硫酸的浓度为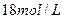 ,铜片是过量的,加热使之反应,当被还原的硫酸为
,铜片是过量的,加热使之反应,当被还原的硫酸为 。则浓硫酸的实际体积(填写“大于”、“等于”或“小于”)
。则浓硫酸的实际体积(填写“大于”、“等于”或“小于”) 。
。
甲、乙、丙、丁四位同学各取了0.1 mol·L-1的一元酸(他们所取的酸可能是不同的)20.00 mL,分别向其中滴加0.1 mol·L-1的一元碱(他们所用的碱也可能是不同的),在滴加过程中不断测定混合液的pH,下表是测得的部分数据。
| 测定溶液的pH |
||||
| 加入碱溶液的体积/mL |
甲 |
乙 |
丙 |
丁 |
| 19.98 |
4.3 |
7.7 |
4.3 |
|
20.0 0 0 |
7.0 |
7.0 |
8.7 |
5.3 |
| 20.02 |
9.7 |
10.0 |
请回答下列问题:
(1)为了较方便准确地量取所用的酸,甲同学量取酸液时左手拿洗耳球,右手所持的玻璃量器是(填该量器的名称),向酸溶液中滴加碱溶液时,所用的仪器是。
(2)分析表中的数据,有一个数据肯定是错误的,该数据是,在回答以下问题时都应该剔除该数据。
(3)四位同学所选用的酸溶液pH最大的是(在甲、乙、丙、丁中选填)。
(4)请计算甲同学在滴入19.98 mL 碱溶液时,溶液的pH约为(保留一位小数,也可用对数形式表示)。
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)
| 甲 |
乙 |
丙 |
丁 |
|
| 建议选用的指示剂 |
实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
| 实验方案(只要求填写选用试剂) |
① |
② |
| 填试剂序号 |
填试剂序号 |
|
| 实验现象 |
一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 |
|
| 有关反应的离子方程式 |
||
| 结论 |
金属性:Mg>Al |
非金属性: |
试剂:①镁条、②铝条、③氯 水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
某校课外实验小组同学设计下图装置进行实验。(夹持装置已略去)。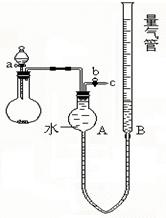
(1)该小组同学用如图装置进行“乙炔的制取及燃烧性质验证”实验。
①制取乙炔的化学方程式是。
②点燃乙炔前,需要。
③在导管口c处点燃乙炔,观察到的现象是;
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是:,并使视线与凹液面最低处相平。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
| 饱和醇的质量 |
金属钠的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
| ① |
0.62 g |
5 .0g(足量) |
40 mL |
264 mL |
| ② |
0.31 g |
2.5 g(足量) |
40 mL |
152mL |
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇是元醇。
实验室配制500mL0.1mol/L Na2CO3溶液回答下列问题
(1)需Na2CO3·10H2O晶体_______g
(2)现有以下仪器:①烧杯 ②250ml容量瓶 ③500ml容量瓶 ④量筒 ⑤玻璃棒 ⑥胶头滴管 ⑦托盘天平,配制Na2CO3溶液时需用的主要仪器有____________。
(3)若实验遇下列情况,配得溶液的浓度是偏高,偏低还是无影响?
A. 容量瓶内壁附有水珠而未干燥处理____________。
B. 溶解后没有冷却便进行定容______________。
C. 定容观察刻度时俯视_____________。